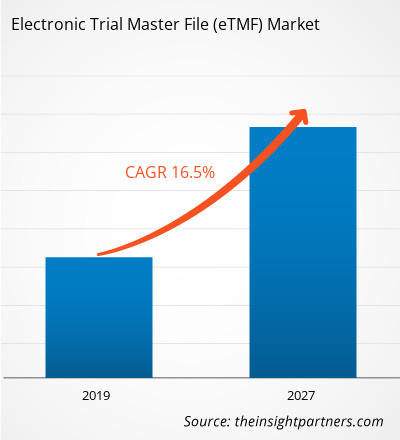
[Forschungsbericht] Der Wert der elektronischen Studienstammdatei im Gesundheitsmarkt wurde im Jahr 2018 auf 938,32 Millionen US-Dollar geschätzt und soll bis 2027 3.155,64 Millionen US-Dollar erreichen; von 2019 bis 2027 wird mit einer durchschnittlichen jährlichen Wachstumsrate von 16,5 % gerechnet.
Electronic Trial Master File (eTMF)-Systeme können als Integration von Software- und Hardwarekomponenten definiert werden, die gemeinsam für die optimale Verwaltung klinischer Studiendaten verantwortlich sind. Diese Lösungen helfen dabei, die im Verlauf einer klinischen Studie generierten Daten in einem einfach zu speichernden digitalen Format zu rationalisieren, das von unterschiedlichen Benutzern abgerufen werden kann, was eine einfache Zugänglichkeit bietet und die mit der administrativen und manuellen Datenpflege bei klinischen Studien verbundenen Kosten senkt. Das Wachstum des Electronic Trial Master File im Gesundheitsmarkt ist auf die zunehmende Anzahl klinischer Studien zurückzuführen, die zunehmende Verbreitung von Krankheiten und der technologische Fortschritt haben den Markt im Laufe der Jahre angekurbelt. Der Mangel an qualifizierten Fachkräften wird sich jedoch in den kommenden Jahren wahrscheinlich negativ auf das Marktwachstum auswirken. Andererseits werden zunehmende strategische Initiativen der Marktteilnehmer in den kommenden Jahren wahrscheinlich Wachstumschancen bieten.
Der Markt für elektronische Studienstammdateien im Gesundheitswesen dürfte nach der Pandemie ein erhebliches Wachstum verzeichnen. COVID-19 hat die Wirtschaft und Industrie in verschiedenen Ländern durch Lockdowns, Reiseverbote und Betriebsschließungen beeinträchtigt. Die COVID-19-Krise hat die öffentlichen Gesundheitssysteme in vielen Ländern überlastet und den starken Bedarf an nachhaltigen Investitionen in die Gesundheitssysteme hervorgehoben. Mit Fortschreiten der COVID-19-Pandemie wird für die Gesundheitsbranche ein Wachstumsrückgang erwartet. Das Segment Biowissenschaften floriert aufgrund der gestiegenen Nachfrage nach In-vitro-Diagnostikprodukten und der weltweit steigenden Forschungs- und Entwicklungsaktivitäten. Das Segment Medizintechnik und Bildgebung verzeichnet jedoch einen Umsatzrückgang aufgrund einer geringeren Anzahl durchgeführter Operationen und einer verzögerten oder verzögerten Gerätebeschaffung. Darüber hinaus wird erwartet, dass virtuelle Konsultationen durch medizinisches Fachpersonal nach der Pandemie zum gängigen Modell der Gesundheitsversorgung werden. Da die Telemedizin die Gesundheitsversorgung verändert, wird die digitale Gesundheit in den kommenden Jahren weiter florieren. Darüber hinaus wird erwartet, dass unterbrochene klinische Studien und die daraus resultierende Verzögerung der Markteinführung von Medikamenten in Zukunft den Weg für vollständig virtuelle Studien ebnen werden. Es wird erwartet, dass neue Technologien wie mRNA auftauchen und die Pharmaindustrie verändern werden, und es wird erwartet, dass der Markt in den kommenden Jahren auch eine stärkere vertikale Integration und mehr Joint Ventures erleben wird.
Passen Sie diesen Bericht Ihren Anforderungen an
Sie erhalten kostenlos individuelle Anpassungen an jedem Bericht, einschließlich Teilen dieses Berichts oder einer Analyse auf Länderebene, eines Excel-Datenpakets sowie tolle Angebote und Rabatte für Start-ups und Universitäten.
- Holen Sie sich die wichtigsten Markttrends aus diesem Bericht.Dieses KOSTENLOSE Beispiel umfasst eine Datenanalyse von Markttrends bis hin zu Schätzungen und Prognosen.
Markteinblicke
Zunehmende Anwendungen elektronischer Studienstammdateien im Gesundheitswesen treiben das Wachstum elektronischer Studienstammdateien im Gesundheitswesen voran
Forschung und Entwicklung (F&E) ist ein wichtiger und wesentlicher Teil des Geschäfts eines Unternehmens. Die Aktivitäten der Pharmaindustrie haben in Form von F&E- und Produktionsinvestitionen erhebliche sozioökonomische Auswirkungen auf die Gesellschaft. Forschung und Entwicklung sind das „Rückgrat“ jedes erfolgreichen Arzneimittelentdeckungssystems, und die elektronische Studienstammdatei ist eine wesentliche Software für die Forschung und Entwicklung neuer pharmazeutischer und biotechnologischer Therapieformen. Pharma- und Biotechunternehmen konzentrieren sich hauptsächlich auf Forschung und Entwicklung (F&E), um neue Moleküle für verschiedene therapeutische Anwendungen mit dem größten medizinischen und kommerziellen Potenzial zu entwickeln. Die Unternehmen investieren hauptsächlich in F&E, um qualitativ hochwertige und innovative Produkte auf den Markt zu bringen. So stiegen beispielsweise die weltweiten F&E-Ausgaben im Jahr 2017 im Vergleich zu 2016 um 3,9 Prozent auf 165 Milliarden US-Dollar. Die durchschnittlichen F&E-Ausgaben stiegen moderat auf 20,9 Prozent als Prozentsatz des gesamten verschreibungspflichtigen Umsatzes. Darüber hinaus gaben Pharmaunternehmen laut einer jährlichen Umfrage unter Mitgliedern der PhRMA im Jahr 2017 an, 71,4 Milliarden US-Dollar für Forschung und Entwicklung ausgegeben zu haben.
Die Pharmaunternehmen investierten mehr in F&E, um ihre klinischen Testprozesse zu beschleunigen. So war AstraZeneca zum 30. Juni 2019 Vorreiter und gab 25,63 % seines Umsatzes für Forschung und Entwicklung aus. Zum 31. März 2019 gab Eli Lilly and Company 22,38 % seines Umsatzes für F&E aus, und Roche Holding AG lag zum 30. Juni 2019 mit 21,29 % für F&E nicht weit dahinter.
Ausgaben für Forschung und Entwicklung fallen in der Regel bei der Entdeckung, Erprobung und Entwicklung neuer Produkte, bei Vorauszahlungen und Meilensteinen, bei der Verbesserung bestehender Ergebnisse sowie beim Nachweis der Wirksamkeit und Einhaltung gesetzlicher Vorschriften vor der Markteinführung an. Darüber hinaus sind die Investitionen in Forschung und Entwicklung von Pharmaunternehmen in den USA in den letzten 15 Jahren kontinuierlich gestiegen.
Die Entwicklung und Entdeckung von Medikamenten ist ein zeitaufwändiger und teurer Prozess. Der Prozess von der Früherkennung oder dem Entwurf über die Entwicklung bis hin zur behördlichen Zulassung kann mehr als 10 bis 15 Jahre dauern. Während der gesamten Entwicklungsphase eines Arzneimittels sind verschiedene Testdienste erforderlich, um die Qualität und Wirksamkeit des Produkts zu überprüfen. Daher bevorzugen Pharma- und Biotechunternehmen die Speicherung der Daten in elektronischen Masterdateien, um Kosten und Zeit zu sparen, was voraussichtlich das Marktwachstum vorantreiben wird.
Klinische Studien sind einer der wichtigsten und bedeutendsten Schritte bei der Arzneimittelentdeckung, um zu ermitteln, ob die Behandlung, die medizinische Strategie oder das Gerät für den menschlichen oder tierärztlichen Gebrauch sicher und wirksam ist. Klinische Studien helfen, die besten Behandlungsansätze für bestimmte Therapiebereiche zu verstehen und zu bestimmen. Klinische Studien werden speziell durchgeführt, um Daten über die Sicherheit und Wirksamkeit der Entwicklung eines neuen Produkts und Werkzeugs zu sammeln. Bevor die Zulassungsbehörden die Arzneimittelmoleküle und Medizinprodukte genehmigen, werden eine Reihe klinischer Studien durchgeführt. Die zunehmende Verbreitung verschiedener übertragbarer und nicht übertragbarer Krankheiten erhöht die Nachfrage nach der Entwicklung neuer Medikamente oder Medizinprodukte zur Behandlung. Dies wiederum wird voraussichtlich die Nachfrage nach klinischen Studienaktivitäten für verschiedene Therapiebereiche erhöhen.
Biopharmazeutische und pharmazeutische Unternehmen, die an klinischen Studien beteiligt sind, möchten von papierbasierten Dokumentenmanagementsystemen in Aktenschränken auf elektronische Dokumentenmanagementsysteme umsteigen, bei denen Dokumente online in elektronischen Archiven gespeichert werden. Durch die Implementierung eines umfassenden eTMF-Systems, das es Unternehmen ermöglicht, TMF-Dokumente zu automatisieren, zu erfassen und zu verwalten und unnötige Risiken aufzuzeichnen, können im Vergleich zu manuellen Papierverarbeitungsprozessen häufig Kosteneinsparungen bei klinischen Studien erzielt werden.
Ein Anstieg der Einführung eines elektronischen Studienstammdateisystems im klinischen Prozess dürfte den Markt ankurbeln. NextDocs von Aurea Software ist beispielsweise ein Forum für elektronische Studienstammdateien (eTMF) für die klinische Zusammenarbeit bei der Verwaltung klinischer Studienunterlagen. Es handelt sich um ein Content-Management-System für die Pharmaindustrie, das eine formalisierte Möglichkeit bietet, Dokumente, Fotos und andere digitale Inhalte für klinische Pharmastudien zu organisieren und zu speichern, die möglicherweise zur Einhaltung der Vorschriften staatlicher Aufsichtsbehörden erforderlich sind. Bei klinischen Studien unterstützt die EMA die Verwendung von eTMF-Systemen zur elektronischen Speicherung als Ersatz für Papier uneingeschränkt. Die Agentur führt in einer Warnmeldung Qualitätsprobleme mit TMFs und eTMFs aufgrund von Papierinhalten und Inkonsistenzen wie fehlenden Seiten, ungeeigneter Beschriftung oder unvollständigen Dokumenten an. Aufgrund innovativer Funktionen von eTMF wie Zentralisierung und Verwaltung der Dokumentation klinischer Studien, leistungsstarker Suchfunktionen (mit Metadaten) und mehrerer Methoden zum Hinzufügen von Dokumenten wird eTMF für die Geschäftseffizienz, Kosteneinsparungen und verkürzte Zeitpläne für die Herstellung von BioPharma-Produkten zur Implementierung elektronischer Dokumentenverwaltungsprozesse immer wichtiger. Das Geheimnis der Einführung interoperabler eTMF-Frameworks liegt in der Verwendung eines gemeinsamen Inhaltsmodells, vokabularbasierter Standards und webbasierter Standardtechnologien.
Aufgrund der Weiterentwicklung der Studienstammdatei zur elektronischen Studienstammdatei übernehmen Auftragsforschungsinstitute sowie Pharma- und Biotechnologieunternehmen die eTMF für ein besseres klinisches Datenmanagement und einen besseren klinischen Studienmanagementprozess. Die oben genannten Gründe und Faktoren fördern das Wachstum des Marktes für elektronische Studienstammdateien.
Komponentenbasierte Erkenntnisse
Was die Komponenten betrifft, ist der Markt für elektronische Studienstammdateien im Gesundheitswesen in Service und Software unterteilt. Das Servicesegment hatte 2019 den größten Marktanteil.
Erkenntnisse basierend auf der Lieferart
Basierend auf dem Bereitstellungsmodus ist das Electronic Trial Master File im Gesundheitsmarkt in Cloud-basiertes ETMF und On-Premise-ETMF segmentiert. Das Cloud-basierte eTMF-Segment hatte 2019 den größten Marktanteil.
Endbenutzerbasierte Erkenntnisse
In Bezug auf den Endnutzer ist der Markt für elektronische Studienstammdateien im Gesundheitswesen in Pharma- und Biotechnologieunternehmen, Cros und andere unterteilt. Das Segment der Pharma- und Biotechnologieunternehmen hatte 2019 den größten Marktanteil.
Die Akteure des Electronic Trial Master File im Gesundheitsmarkt verfolgen Strategien zur Produkteinführung und -erweiterung, um den sich weltweit ändernden Kundenanforderungen gerecht zu werden und so ihren Markennamen weltweit zu wahren.
Regionale Einblicke in den Markt für elektronische Studienmasterdateien (eTMF)
Die regionalen Trends und Faktoren, die den Markt für Electronic Trial Master File (eTMF) während des gesamten Prognosezeitraums beeinflussen, wurden von den Analysten von Insight Partners ausführlich erläutert. In diesem Abschnitt werden auch die Marktsegmente und die Geografie von Electronic Trial Master File (eTMF) in Nordamerika, Europa, im asiatisch-pazifischen Raum, im Nahen Osten und Afrika sowie in Süd- und Mittelamerika erörtert.
- Erhalten Sie regionale Daten zum Electronic Trial Master File (eTMF)-Markt
Umfang des Marktberichts zum Electronic Trial Master File (eTMF)
| Berichtsattribut | Details |
|---|---|
| Marktgröße im Jahr 2018 | 938,32 Millionen US-Dollar |
| Marktgröße bis 2027 | 3.155,64 Millionen US-Dollar |
| Globale CAGR (2018 - 2027) | 16,5 % |
| Historische Daten | 2016-2017 |
| Prognosezeitraum | 2019–2027 |
| Abgedeckte Segmente | Nach Komponente
|
| Abgedeckte Regionen und Länder | Nordamerika
|
| Marktführer und wichtige Unternehmensprofile |
|
Dichte der Marktteilnehmer im Electronic Trial Master File (eTMF): Die Auswirkungen auf die Geschäftsdynamik verstehen
Der Markt für Electronic Trial Master File (eTMF) wächst rasant, angetrieben von der steigenden Nachfrage der Endnutzer aufgrund von Faktoren wie sich entwickelnden Verbraucherpräferenzen, technologischen Fortschritten und einem größeren Bewusstsein für die Vorteile des Produkts. Mit steigender Nachfrage erweitern Unternehmen ihr Angebot, entwickeln Innovationen, um die Bedürfnisse der Verbraucher zu erfüllen, und nutzen neue Trends, was das Marktwachstum weiter ankurbelt.
Die Marktteilnehmerdichte bezieht sich auf die Verteilung der Firmen oder Unternehmen, die in einem bestimmten Markt oder einer bestimmten Branche tätig sind. Sie gibt an, wie viele Wettbewerber (Marktteilnehmer) in einem bestimmten Marktraum im Verhältnis zu seiner Größe oder seinem gesamten Marktwert präsent sind.
Die wichtigsten auf dem Markt für elektronische Testmasterdateien (eTMF) tätigen Unternehmen sind:
- Aurea, Inc.
- TRANSPERFEKT
- Covance Inc (Laborunternehmen)
- Orakel
- Ennov
Haftungsausschluss : Die oben aufgeführten Unternehmen sind nicht in einer bestimmten Reihenfolge aufgeführt.
- Überblick über die wichtigsten Akteure auf dem Electronic Trial Master File (eTMF)-Markt
Elektronische Studienstammdatei im Gesundheitsmarkt – nach Komponenten
- Service
- Software
Elektronische Studienstammdatei im Gesundheitsmarkt – nach Bereitstellungsmodus
- Cloudbasiertes eTMF
- Vor-Ort-eTMF
Elektronische Studienstammdatei im Gesundheitsmarkt – nach Endbenutzer
- Pharma- und Biotechnologieunternehmen
- Auftragsforschungsinstitute
- Sonstiges
Electronic Trial Master File im Gesundheitsmarkt – nach Geografie
Nordamerika
- UNS
- Kanada
- Mexiko
Europa
- Frankreich
- Deutschland
- Italien
- Vereinigtes Königreich
- Spanien
- Restliches Europa
Asien-Pazifik (APAC)
- China
- Indien
- Südkorea
- Japan
- Australien
- Restlicher Asien-Pazifik-Raum
Naher Osten und Afrika (MEA)
- Südafrika
- Saudi-Arabien
- Vereinigte Arabische Emirate
- Rest von MEA
Südamerika und Mittelamerika (SCAM)
- Brasilien
- Argentinien
- Rest von SCAM
Firmenprofile
- Aurea, Inc.
- Transperfekt.
- Covance Inc (Laborunternehmen)
- Orakel
- Ennov
- Mastercontrol, Inc.
- Omnicom
- Pharmaüberwachung
- Veeva-Systeme
- Phlexglobal
- Historische Analyse (2 Jahre), Basisjahr, Prognose (7 Jahre) mit CAGR
- PEST- und SWOT-Analyse
- Marktgröße Wert/Volumen – Global, Regional, Land
- Branche und Wettbewerbsumfeld
- Excel-Datensatz

Report Coverage
Revenue forecast, Company Analysis, Industry landscape, Growth factors, and Trends
Segment Covered
This text is related
to segments covered.

Regional Scope
North America, Europe, Asia Pacific, Middle East & Africa, South & Central America
Country Scope
This text is related
to country scope.
Häufig gestellte Fragen
Pharmaceutical and biotechnology companies, contract research organizations (CROs) and other users can make use of electronic trial master file (eTMF).
Increasing in number of clinical trial, increasing prevalence of diseases and technology advancement have been boosting the market over the years. However, dearth of skilled professionals is likely to have a negative impact on the growth of the market in the coming years. On the other hand, increasing strategic initiatives by market players is likely to provide growth opportunities over the coming years.
Electronic trial master file (eTMF) systems can be defined as an integration of software and hardware components collectively responsible for the optimal management of clinical trial data. These solutions help to streamline the data generated during the course of a clinical trial in an easy-to-store digital format, which can be retrieved by dissimilar users beneficial in easy accessibility and reduction the cost associated with the administrative and manual data maintenance operations in clinical trials.
Trends and growth analysis reports related to Technology, Media and Telecommunications : READ MORE..
The List of Companies - Electronic Trial Master File (eTMF) Market
- Aurea, Inc.
- TRANSPERFECT
- Covance Inc (Lab Corp)
- Oracle
- Ennov
- Mastercontrol, Inc.
- Omnicomm
- Pharmavigilalnce
- Veeva Systems
- Phlexglobal
The Insight Partners performs research in 4 major stages: Data Collection & Secondary Research, Primary Research, Data Analysis and Data Triangulation & Final Review.
- Data Collection and Secondary Research:
As a market research and consulting firm operating from a decade, we have published and advised several client across the globe. First step for any study will start with an assessment of currently available data and insights from existing reports. Further, historical and current market information is collected from Investor Presentations, Annual Reports, SEC Filings, etc., and other information related to company’s performance and market positioning are gathered from Paid Databases (Factiva, Hoovers, and Reuters) and various other publications available in public domain.
Several associations trade associates, technical forums, institutes, societies and organization are accessed to gain technical as well as market related insights through their publications such as research papers, blogs and press releases related to the studies are referred to get cues about the market. Further, white papers, journals, magazines, and other news articles published in last 3 years are scrutinized and analyzed to understand the current market trends.
- Primary Research:
The primarily interview analysis comprise of data obtained from industry participants interview and answers to survey questions gathered by in-house primary team.
For primary research, interviews are conducted with industry experts/CEOs/Marketing Managers/VPs/Subject Matter Experts from both demand and supply side to get a 360-degree view of the market. The primary team conducts several interviews based on the complexity of the markets to understand the various market trends and dynamics which makes research more credible and precise.
A typical research interview fulfils the following functions:
- Provides first-hand information on the market size, market trends, growth trends, competitive landscape, and outlook
- Validates and strengthens in-house secondary research findings
- Develops the analysis team’s expertise and market understanding
Primary research involves email interactions and telephone interviews for each market, category, segment, and sub-segment across geographies. The participants who typically take part in such a process include, but are not limited to:
- Industry participants: VPs, business development managers, market intelligence managers and national sales managers
- Outside experts: Valuation experts, research analysts and key opinion leaders specializing in the electronics and semiconductor industry.
Below is the breakup of our primary respondents by company, designation, and region:
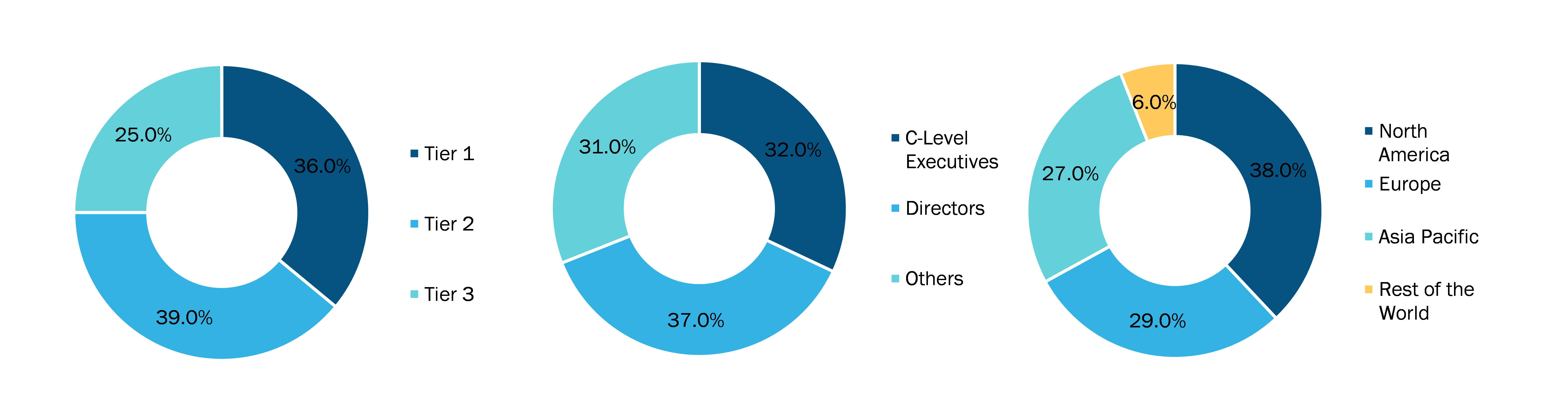
Once we receive the confirmation from primary research sources or primary respondents, we finalize the base year market estimation and forecast the data as per the macroeconomic and microeconomic factors assessed during data collection.
- Data Analysis:
Once data is validated through both secondary as well as primary respondents, we finalize the market estimations by hypothesis formulation and factor analysis at regional and country level.
- Macro-Economic Factor Analysis:
We analyse macroeconomic indicators such the gross domestic product (GDP), increase in the demand for goods and services across industries, technological advancement, regional economic growth, governmental policies, the influence of COVID-19, PEST analysis, and other aspects. This analysis aids in setting benchmarks for various nations/regions and approximating market splits. Additionally, the general trend of the aforementioned components aid in determining the market's development possibilities.
- Country Level Data:
Various factors that are especially aligned to the country are taken into account to determine the market size for a certain area and country, including the presence of vendors, such as headquarters and offices, the country's GDP, demand patterns, and industry growth. To comprehend the market dynamics for the nation, a number of growth variables, inhibitors, application areas, and current market trends are researched. The aforementioned elements aid in determining the country's overall market's growth potential.
- Company Profile:
The “Table of Contents” is formulated by listing and analyzing more than 25 - 30 companies operating in the market ecosystem across geographies. However, we profile only 10 companies as a standard practice in our syndicate reports. These 10 companies comprise leading, emerging, and regional players. Nonetheless, our analysis is not restricted to the 10 listed companies, we also analyze other companies present in the market to develop a holistic view and understand the prevailing trends. The “Company Profiles” section in the report covers key facts, business description, products & services, financial information, SWOT analysis, and key developments. The financial information presented is extracted from the annual reports and official documents of the publicly listed companies. Upon collecting the information for the sections of respective companies, we verify them via various primary sources and then compile the data in respective company profiles. The company level information helps us in deriving the base number as well as in forecasting the market size.
- Developing Base Number:
Aggregation of sales statistics (2020-2022) and macro-economic factor, and other secondary and primary research insights are utilized to arrive at base number and related market shares for 2022. The data gaps are identified in this step and relevant market data is analyzed, collected from paid primary interviews or databases. On finalizing the base year market size, forecasts are developed on the basis of macro-economic, industry and market growth factors and company level analysis.
- Data Triangulation and Final Review:
The market findings and base year market size calculations are validated from supply as well as demand side. Demand side validations are based on macro-economic factor analysis and benchmarks for respective regions and countries. In case of supply side validations, revenues of major companies are estimated (in case not available) based on industry benchmark, approximate number of employees, product portfolio, and primary interviews revenues are gathered. Further revenue from target product/service segment is assessed to avoid overshooting of market statistics. In case of heavy deviations between supply and demand side values, all thes steps are repeated to achieve synchronization.
We follow an iterative model, wherein we share our research findings with Subject Matter Experts (SME’s) and Key Opinion Leaders (KOLs) until consensus view of the market is not formulated – this model negates any drastic deviation in the opinions of experts. Only validated and universally acceptable research findings are quoted in our reports.
We have important check points that we use to validate our research findings – which we call – data triangulation, where we validate the information, we generate from secondary sources with primary interviews and then we re-validate with our internal data bases and Subject matter experts. This comprehensive model enables us to deliver high quality, reliable data in shortest possible time.

 Holen Sie sich ein kostenloses Muster für diesen Bericht
Holen Sie sich ein kostenloses Muster für diesen Bericht