Der Markt für Pharmakovigilanz- und Arzneimittelsicherheitssoftware wird voraussichtlich von 214,39 Millionen US-Dollar im Jahr 2023 auf 359,30 Millionen US-Dollar im Jahr 2031 anwachsen. Der Markt wird zwischen 2023 und 2031 voraussichtlich eine durchschnittliche jährliche Wachstumsrate (CAGR) von 6,7 % verzeichnen. Cloudbasierte Pharmakovigilanz- und Arzneimittelsicherheitssoftware wird in den kommenden Jahren wahrscheinlich neue wichtige Trends auf den Markt bringen.
Marktanalyse für Pharmakovigilanz- und Arzneimittelsicherheitssoftware
Die zunehmende Integration von Technologien wie künstlicher Intelligenz und maschinellem Lernen mit Pharmakovigilanz- und Arzneimittelsicherheitssoftware zur Automatisierung von Arzneimittelsicherheitsaufgaben treibt den Markt an. Mehrere wichtige Akteure integrieren diese fortschrittlichen Technologien, um den Arbeitsablauf in der Pharmaindustrie zu automatisieren. So brachte PubHive Ltd., ein Anbieter von KI-gestützten Workflows für wissenschaftliche Sicherheit und Literaturinformationen, im Januar 2024 eine zentralisierte Verwaltungssoftware für Zusammenfassungen der Produkteigenschaften (SmPC) mit KI-gestützten Pharmakovigilanz-Workflows für Biowissenschaftsunternehmen auf den Markt. Das Unternehmen bietet seine Software klinischen Forschungsorganisationen (CROs) und deren Abteilungen für Pharmakovigilanz und Arzneimittelsicherheit an. Diese KI-basierte Lösung vereinfacht und rationalisiert Prozesse und hilft bei der Einhaltung von Vorschriften. Darüber hinaus ermöglicht sie es Pharmakovigilanzteams, schneller und effektiver zu arbeiten.
Marktübersicht für Pharmakovigilanz- und Arzneimittelsicherheitssoftware
Software für Pharmakovigilanz und Arzneimittelsicherheit ist ein wichtiges Instrument, das neben verschiedenen anderen Herausforderungen Fehler bei der manuellen Dateneingabe behebt und die enorme Menge an Sicherheitsdaten verwaltet. Von klinischen Studien bis zur Überwachung nach der Markteinführung ist diese Software während des gesamten Lebenszyklus der Arzneimittelentwicklung unverzichtbar. Software für Pharmakovigilanz und Arzneimittelsicherheit trägt dazu bei, die Bearbeitungszeit für unerwünschte Ereignisse zu verkürzen und die Patientensicherheit durch frühzeitige Signalerkennung zu verbessern. Da sich die Vorschriften weiterentwickeln und die Zusammenarbeit zwischen europäischen Unternehmen intensiviert wird, wird die Einführung von Software für Pharmakovigilanz und Arzneimittelsicherheit für Pharmaunternehmen und Aufsichtsbehörden unabdingbar. Im Jahr 2022 aktualisierte das Pharmaceutical Inspection Co-operation Scheme (PIC/S) seine Richtlinien zur Pharmakovigilanz, um internationalen Standards zu entsprechen, und betonte dabei die Bedeutung einer robusten Software für Pharmakovigilanz und Arzneimittelsicherheit. Außerdem veröffentlichte die US-amerikanische Food and Drug Administration (FDA) im März 2024 Leitlinien zur Einreichung von Sicherheitsberichten für neue Prüfpräparate (IND) für schwere und vermutete unerwünschte Ereignisse im Zusammenhang mit Arzneimitteln. Diese Berichte werden im Format „Electronic Common Technical Document“ (eCTD) in Form von PDF-Dateien eingereicht. Darüber hinaus gewährleistet die Software die Einhaltung gesetzlicher Vorschriften, indem sie die Erstellung umfassender Sicherheitsberichte und die Einreichung bei den Aufsichtsbehörden erleichtert. So können Unternehmen Strafen vermeiden und ihren Ruf wahren.
Passen Sie die Forschung Ihren Anforderungen an
Wir können die Analyse und den Umfang optimieren und anpassen, die unsere Standardangebote nicht abdecken. Diese Flexibilität hilft Ihnen, genau die Informationen zu erhalten, die Sie für Ihre Geschäftsplanung und Entscheidungsfindung benötigen.
Markt für Pharmakovigilanz- und Arzneimittelsicherheitssoftware:
CAGR (2023 - 2031)6,7 %- Marktgröße 2023
214,39 Millionen US-Dollar - Marktgröße 2031
359,30 Millionen US-Dollar

Marktdynamik
- Anstieg der Fälle unerwünschter Arzneimittelwirkungen
- Globalisierung der Pharmakovigilanz
- Anstieg der Ausgaben für Arzneimittelentwicklung
- Cloudbasierte Pharmakovigilanz
- Software zur Arzneimittelsicherheit
- Integration von Software mit KI, ML
- NLP
Schlüsselspieler
- ArisEurope
- ICON plc
- Syneos Gesundheit
- Accenture
- IQVIA
- Genpact
- Bewusst
- Paraxel International Corporation
- Beteiligungen an der Laboratory Corporation of America
- Maximale Anwendung
Regionaler Überblick
- Nordamerika
- Europa
- Asien-Pazifik
- Süd- und Mittelamerika
- Naher Osten und Afrika
Marktsegmentierung
 Angebot
Angebot- Software
- Dienstleistungen
 Einsatz
Einsatz- Wolke
- Vor Ort
 Unternehmensgröße
Unternehmensgröße- Große Unternehmen
- KMU
 Bilden
Bilden- Standard
- Individuell
- Das Beispiel-PDF zeigt die Inhaltsstruktur und die Art der Informationen mit qualitativer und quantitativer Analyse.
Treiber und Chancen auf dem Markt für Pharmakovigilanz- und Arzneimittelsicherheitssoftware
Anstieg der Fälle unerwünschter Arzneimittelwirkungen begünstigt Markt
Aufgrund der zunehmenden Verbreitung chronischer Krankheiten nehmen die Fälle unerwünschter Arzneimittelwirkungen (UAW) weltweit zu . Da alle Arzneimittel das Potenzial für unerwünschte Arzneimittelwirkungen haben, ist bei jeder Verschreibung eines Arzneimittels eine Risiko-Nutzen-Analyse erforderlich. UAW bleiben im modernen Gesundheitswesen eine Herausforderung, insbesondere angesichts der wachsenden Komplexität der Therapeutika, einer alternden Bevölkerung und einer weltweit zunehmenden Multimorbidität. Mithilfe von Pharmakovigilanzsoftware können Gesundheitsdienstleister und Pharmaunternehmen Daten zu UAW systematisch erfassen, analysieren und melden und die damit verbundenen Herausforderungen bewältigen. Die weltweit zunehmende Verbreitung von UAW treibt die Nachfrage nach Software für Pharmakovigilanz und Arzneimittelsicherheit an. Laut der UAW-Datenbank des Adverse Event Reporting System (FAERS) der US-amerikanischen Food and Drug Administration wurden im Jahr 2022 mehr als 1,25 Millionen schwere Nebenwirkungen sowie über 175.000 Todesfälle gemeldet.
ADRs sind eine der Hauptursachen für die weltweit steigende Sterberate. Laut dem Bericht der Europäischen Drogenagentur (EUDA) betrug die Sterberate in der Europäischen Union im Jahr 2021 in Bezug auf Überdosierungen etwa 18,3 Todesfälle pro Million Menschen im Alter zwischen 15 und 64 Jahren. Außerdem gab es in der Europäischen Union im Jahr 2021 mindestens 6.166 Todesfälle durch Überdosierungen illegaler Drogen (5.796 im Jahr 2020). Diese Gesamtzahl erreichte etwa 6.677 Todesfälle, wenn Norwegen und die Türkei einbezogen wurden (6.434 im Jahr 2020).
Die Exposition gegenüber Theophyllin und Atemdepressionen steigt mit der Verwendung von Makrolidantibiotika und erhöhtem Vitamin-K-Konsum, was zu UAW führt. Da immer mehr UAW gemeldet und erkannt werden, stehen Pharmaunternehmen, Gesundheitsdienstleister und Aufsichtsbehörden unter größerem Druck, die Überwachungs- und Meldeprozesse für die Arzneimittelsicherheit zu verbessern. Software für Pharmakovigilanz und Arzneimittelsicherheit hilft, die mit übermäßigem Arzneimittelkonsum verbundenen Risiken zu vermeiden. Diese Software hilft dabei, den Prozess der Erkennung, Bewertung und Vorbeugung von Nebenwirkungen zu optimieren und ermöglicht schnellere Reaktionszeiten und genauere Risikobewertungen. Somit treibt die steigende Zahl unerwünschter Arzneimittelwirkungen das Wachstum des globalen Marktes für Software für Pharmakovigilanz und Arzneimittelsicherheit an .
Globalisierung der Pharmakovigilanz
Pharmakovigilanz ist der Prozess der Überwachung und Bewertung von Nebenwirkungen von Arzneimitteln und ein wichtiger Bestandteil effektiver Arzneimittelregulierungssysteme, der klinischen Praxis und von öffentlichen Gesundheitsprogrammen. Die Globalisierung der Pharmakovigilanz fördert die Zusammenarbeit zwischen Beteiligten wie Regulierungsbehörden, Gesundheitsdienstleistern und Pharmaunternehmen. Die Europäische Arzneimittel-Agentur (EMA) beispielsweise legt zunehmend Wert auf die Zusammenarbeit mit internationalen Pharmaregulierungsbehörden, um sich auf Bereiche wie Arzneimittelsicherheit, Inspektionen und Informationsaustausch zu Fragen von gemeinsamem Interesse zu konzentrieren . Ein derartiges kollaboratives Umfeld erleichtert den Datenaustausch und verbessert das allgemeine Verständnis von Arzneimittelsicherheitsprofilen. Da Unternehmen versuchen, diese globalen Netzwerke zu ihren Gunsten zu nutzen, wird der Bedarf an integrierten Pharmakovigilanzlösungen, die rund um den Globus einsetzbar sind, immer wichtiger.
Die Regierungen verschiedener Länder auf der ganzen Welt führen Pharmakovigilanzprogramme durch, indem sie mit den Aufsichtsbehörden ihrer jeweiligen Länder zusammenarbeiten. Die Aufsichtsbehörden sind sich der Bedeutung der Pharmakovigilanz für die Gewährleistung der Arzneimittelsicherheit bewusst. In Nordamerika beispielsweise erlässt die US-amerikanische FDA Richtlinien, Gesetze und Vorschriften zur Durchführung verschiedener Praktiken wie dem Good Clinical Practice Program (GCP) und dem Good Pharmacovigilance Practice Program (GVP), die für biomedizinische Produkte gelten. Darüber hinaus veröffentlichten die Indian Pharmacopoeia Commission und die Central Drugs Standard Control Organization im September 2024 die Version 2.0 ihrer Pharmakovigilanzrichtlinien, indem sie Änderungen wie die Verlängerung der Frist für die Meldung nicht schwerwiegender unerwünschter ADRs und die Überarbeitung der Aufzeichnungspflichten vornahmen. Darüber hinaus veröffentlichte die malaysische National Pharmaceutical Regulatory Agency die zweite überarbeitete Ausgabe ihrer Richtlinien zu Bioäquivalenz- und Pharmakovigilanzinspektionen. Die Agentur stellte weitere Informationen zum Arzneimittelinspektionsprozess und zum Umfang der Bewertungen im Zusammenhang mit Arzneimittelbewertungen zur Verfügung. Auch die philippinische Lebensmittel- und Arzneimittelzulassungsbehörde (FDA) hat als Reaktion auf Rückmeldungen zur Registrierung neuer Arzneimittel und zur Bereitstellung von Informationen zu pharmazeutischen Wirkstoffen (APIs) für die Anwendung am Menschen detaillierte Maßnahmen veröffentlicht.
Marktbericht zu Pharmakovigilanz- und Arzneimittelsicherheitssoftware – Segmentierungsanalyse
Wichtige Segmente, die zur Ableitung der Marktanalyse für Pharmakovigilanz- und Arzneimittelsicherheitssoftware beigetragen haben, sind Angebot, Organisationsgröße, Bereitstellung, Form, Funktionalität und Endbenutzer.
- Basierend auf der Unternehmensgröße ist der europäische Markt für Pharmakovigilanz- und Arzneimittelsicherheitssoftware in Großunternehmen und KMU unterteilt. Das Segment der Großunternehmen dominierte den Markt im Jahr 2023.
- Angebotsmäßig ist der Markt in Software und Dienstleistungen unterteilt. Das Softwaresegment hatte im Jahr 2023 einen größeren Marktanteil.
- Basierend auf der Bereitstellung ist der europäische Markt für Pharmakovigilanz- und Arzneimittelsicherheitssoftware in Cloud und On-Premises unterteilt. Das Cloud-Segment dominierte den Markt im Jahr 2023
- Basierend auf der Form ist der europäische Markt für Pharmakovigilanz- und Arzneimittelsicherheitssoftware in Standard- und kundenspezifische Software unterteilt. Das Standardsegment dominierte den Markt im Jahr 2023.
- Nach Funktionalität ist der europäische Markt für Pharmakovigilanz- und Arzneimittelsicherheitssoftware in Fallmanagement, Signal- und Risikomanagement, Qualität und Compliance, Auditunterstützung und Schulungscompliance, Problemverfolgung und Verfolgung unerwünschter Ereignisse, klinisches Sicherheitsmanagement und Sicherheit klinischer Studien, medizinisches Schreiben, Gesundheitsanalytik und andere unterteilt. Das Segment Signal- und Risikomanagement hatte im Jahr 2023 den größten Marktanteil.
- Basierend auf dem Endnutzer ist der europäische Markt für Pharmakovigilanz- und Arzneimittelsicherheitssoftware in Pharma- und Biotechnologieunternehmen, Auftragsforschungsinstitute, Unternehmen zur Auslagerung von Geschäftsprozessen und andere Pharmakovigilanzdienstleister segmentiert. Das Segment der Pharma- und Biotechnologieunternehmen dominierte den Markt im Jahr 2023.
Marktanteilsanalyse für Pharmakovigilanz- und Arzneimittelsicherheitssoftware nach geografischen Gesichtspunkten
Der Markt für Pharmakovigilanz- und Arzneimittelsicherheitssoftware ist in fünf Hauptregionen unterteilt: Nordamerika, Europa, Asien-Pazifik (APAC), Naher Osten und Afrika (MEA) sowie Süd- und Mittelamerika. Nordamerika dominierte den Markt im Jahr 2023, gefolgt von Europa und APAC.
Nordamerika erlebt ein enormes Wachstum auf dem Markt für Pharmakovigilanz- und Arzneimittelsicherheitssoftware, was auf die Präsenz verschiedener Marktteilnehmer wie IQVIA Oracle Corporation zurückzuführen ist, die kontinuierlich an der Weiterentwicklung von Pharmakovigilanz- und Arzneimittelsicherheitssoftware arbeiten. Im Juli 2024 brachte Oracle Corporation eine KI-basierte Oracle Argus-Plattform als Safety One Intake-Lösung auf den Markt. Diese Lösung hilft Life-Science-Organisationen, den wachsenden regulatorischen Anforderungen gerecht zu werden und die steigende Zahl von Fällen unerwünschter Ereignisse einzudämmen. Diese neue Pharmakovigilanzplattform zielte darauf ab, die Produktivität zu steigern, den Datenschutz zu verbessern und die Berichterstattung zu verbessern. Daher treiben solche Produktinnovationen der Marktteilnehmer in der Region das Wachstum des Marktes für Pharmakovigilanz- und Arzneimittelsicherheitssoftware voran.
Umfang des Marktberichts zu Software für Pharmakovigilanz und Arzneimittelsicherheit
| Berichtsattribut | Details |
|---|---|
| Marktgröße im Jahr 2023 | 214,39 Millionen US-Dollar |
| Marktgröße bis 2031 | 359,30 Millionen US-Dollar |
| Globale CAGR (2023 - 2031) | 6,7 % |
| Historische Daten | 2021-2022 |
| Prognosezeitraum | 2024–2031 |
| Abgedeckte Segmente | Durch das Angebot
|
| Abgedeckte Regionen und Länder | Nordamerika
|
| Marktführer und wichtige Unternehmensprofile |
|
- Das Beispiel-PDF zeigt die Inhaltsstruktur und die Art der Informationen mit qualitativer und quantitativer Analyse.
Neuigkeiten und aktuelle Entwicklungen zum Markt für Pharmakovigilanz- und Arzneimittelsicherheitssoftware
Der Markt für Pharmakovigilanz- und Arzneimittelsicherheitssoftware wird durch die Erfassung qualitativer und quantitativer Daten nach Primär- und Sekundärforschung bewertet, die wichtige Unternehmensveröffentlichungen, Verbandsdaten und Datenbanken umfasst. Nachfolgend sind einige der wichtigsten Entwicklungen auf dem Markt für Pharmakovigilanz- und Arzneimittelsicherheitssoftware aufgeführt:
- ArisGlobal, ein Marktführer für globale Technologielösungen zur Arzneimittelentwicklung, gab bekannt, dass Medac, ein in Deutschland ansässiger Pharmahersteller, der auf die Bereiche Onkologie und Hämatologie, Urologie und Autoimmunerkrankungen spezialisiert ist, sich für LifeSphere Safety entschieden hat, um seine Arzneimittelsicherheitsprozesse zu modernisieren. Präzise, patienten- und populationsspezifische Analysen sind entscheidend, um die Behandlungsrisiken für Patienten zu minimieren und so das bestmögliche Behandlungsergebnis zu unterstützen. (Quelle: ArisGlobal, Pressemitteilung, Mai 2023)
- IQVIA, ein weltweit führender Anbieter von fortschrittlichen Analysen, Technologielösungen und klinischen Forschungsdienstleistungen für die Biowissenschaftsbranche, gab eine strategische Zusammenarbeit mit Argenx bekannt, um die Behandlung von Patienten mit seltenen Autoimmunerkrankungen durch innovative und integrierte technologiegestützte Pharmakovigilanz-Sicherheitsdienste und -lösungen zu verbessern. (Quelle: IQVIA, Pressemitteilung, Januar 2023)
Marktbericht zu Software für Pharmakovigilanz und Arzneimittelsicherheit – Umfang und Ergebnisse
Die „Marktgröße und Prognose für Software zur Pharmakovigilanz und Arzneimittelsicherheit (2021–2031)“ bietet eine detaillierte Analyse des Marktes, die die unten genannten Bereiche abdeckt:
- Marktgröße und Prognose für Pharmakovigilanz- und Arzneimittelsicherheitssoftware auf globaler, regionaler und Länderebene für alle wichtigen Marktsegmente, die im Rahmen des Berichts abgedeckt sind
- Markttrends und Marktdynamiken für Pharmakovigilanz- und Arzneimittelsicherheitssoftware wie Treiber, Beschränkungen und wichtige Chancen
- Detaillierte PEST- und SWOT-Analyse
- Marktanalyse für Pharmakovigilanz- und Arzneimittelsicherheitssoftware mit Blick auf wichtige Markttrends, globale und regionale Rahmenbedingungen, wichtige Akteure, Vorschriften und aktuelle Marktentwicklungen
- Branchenlandschaft und Wettbewerbsanalyse, die die Marktkonzentration, Heatmap-Analyse, prominente Akteure und aktuelle Entwicklungen auf dem Markt für Pharmakovigilanz- und Arzneimittelsicherheitssoftware umfasst
- Detaillierte Firmenprofile
- Historische Analyse (2 Jahre), Basisjahr, Prognose (7 Jahre) mit CAGR
- PEST- und SWOT-Analyse
- Marktgröße Wert/Volumen – Global, Regional, Land
- Branche und Wettbewerbsumfeld
- Excel-Datensatz
- Mail Order Pharmacy Market
- Portable Power Station Market
- Intraoperative Neuromonitoring Market
- Adaptive Traffic Control System Market
- Photo Printing Market
- Hydrolyzed Collagen Market
- Long Read Sequencing Market
- Semiconductor Metrology and Inspection Market
- Flexible Garden Hoses Market
- Asset Integrity Management Market

Report Coverage
Revenue forecast, Company Analysis, Industry landscape, Growth factors, and Trends
Segment Covered
This text is related
to segments covered.

Regional Scope
North America, Europe, Asia Pacific, Middle East & Africa, South & Central America
Country Scope
This text is related
to country scope.
Häufig gestellte Fragen
Integration of cloud-based platforms that offers real-time access to data from anywhere across the globe, enabling pharmaceutical companies to respond swiftly to emerging safety concerns.
ArisEurope, ICON plc, Syneos Health, Accenture, IQVIA, Genpact, Cognizant, Paraxel International Corporation, Laboratory Corporation of America Holdings, Max Application, Clinevo Technologies, Qinecsa Solutions, AB Cube, and Veeva Systems are among the key players operating in the global pharmacovigilance and drug safety software market.
The pharmacovigilance and drug safety software market was valued at US$ 214.39 billion in 2023 and is anticipated to grow at a CAGR of 6.7% over the forecast period.
The rising cases of adverse drug reactions (ADRs) worldwide owing to the increasing prevalence of chronic diseases drives the market growth.
Asia Pacific is anticipated to grow at the fastest CAGR over the forecast period.
The software segment led the pharmacovigilance and drug safety software market with a significant share in 2023.
The pharmacovigilance and drug safety software market are expected to reach US$ 359.30 million by 2031 and is expected to register a CAGR of 6.7% during 2023–2031.
Trends and growth analysis reports related to Technology, Media and Telecommunications : READ MORE..
The List of Companies - Pharmacovigilance and Drug Safety Software Market
- ArisGlobal LLC
- Max Application
- Oracle Corp
- Veeva Systems Inc
- IQVIA Holdings Inc
- ICON Plc
- Cognizant Technology Solutions Corp
- Accenture Plc
- Syneos Health Inc
- Genpact Ltd.
The Insight Partners performs research in 4 major stages: Data Collection & Secondary Research, Primary Research, Data Analysis and Data Triangulation & Final Review.
- Data Collection and Secondary Research:
As a market research and consulting firm operating from a decade, we have published and advised several client across the globe. First step for any study will start with an assessment of currently available data and insights from existing reports. Further, historical and current market information is collected from Investor Presentations, Annual Reports, SEC Filings, etc., and other information related to company’s performance and market positioning are gathered from Paid Databases (Factiva, Hoovers, and Reuters) and various other publications available in public domain.
Several associations trade associates, technical forums, institutes, societies and organization are accessed to gain technical as well as market related insights through their publications such as research papers, blogs and press releases related to the studies are referred to get cues about the market. Further, white papers, journals, magazines, and other news articles published in last 3 years are scrutinized and analyzed to understand the current market trends.
- Primary Research:
The primarily interview analysis comprise of data obtained from industry participants interview and answers to survey questions gathered by in-house primary team.
For primary research, interviews are conducted with industry experts/CEOs/Marketing Managers/VPs/Subject Matter Experts from both demand and supply side to get a 360-degree view of the market. The primary team conducts several interviews based on the complexity of the markets to understand the various market trends and dynamics which makes research more credible and precise.
A typical research interview fulfils the following functions:
- Provides first-hand information on the market size, market trends, growth trends, competitive landscape, and outlook
- Validates and strengthens in-house secondary research findings
- Develops the analysis team’s expertise and market understanding
Primary research involves email interactions and telephone interviews for each market, category, segment, and sub-segment across geographies. The participants who typically take part in such a process include, but are not limited to:
- Industry participants: VPs, business development managers, market intelligence managers and national sales managers
- Outside experts: Valuation experts, research analysts and key opinion leaders specializing in the electronics and semiconductor industry.
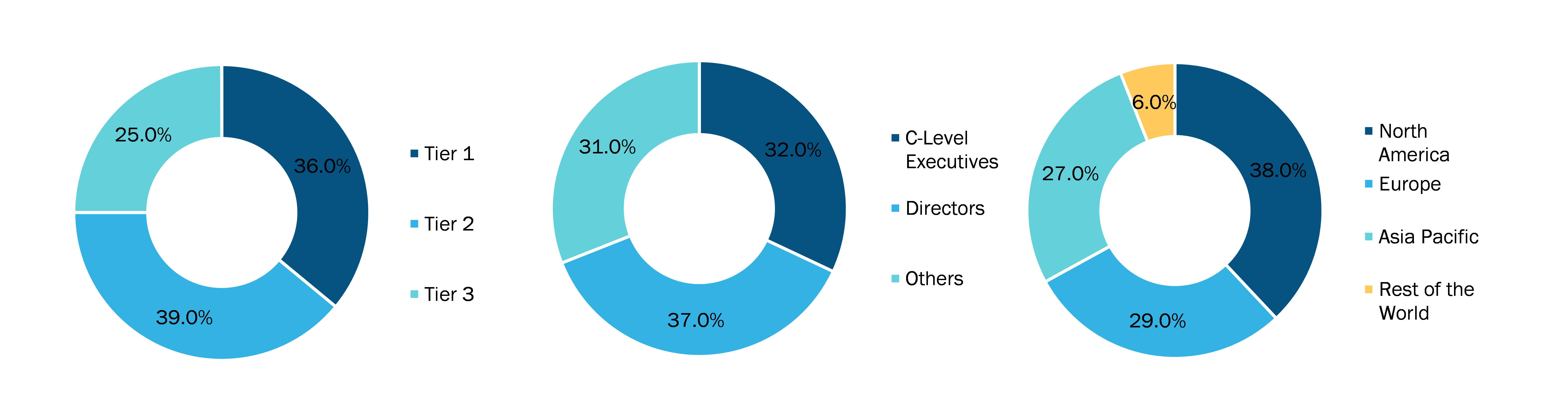
Below is the breakup of our primary respondents by company, designation, and region:
Once we receive the confirmation from primary research sources or primary respondents, we finalize the base year market estimation and forecast the data as per the macroeconomic and microeconomic factors assessed during data collection.
- Data Analysis:
Once data is validated through both secondary as well as primary respondents, we finalize the market estimations by hypothesis formulation and factor analysis at regional and country level.
- Macro-Economic Factor Analysis:
We analyse macroeconomic indicators such the gross domestic product (GDP), increase in the demand for goods and services across industries, technological advancement, regional economic growth, governmental policies, the influence of COVID-19, PEST analysis, and other aspects. This analysis aids in setting benchmarks for various nations/regions and approximating market splits. Additionally, the general trend of the aforementioned components aid in determining the market's development possibilities.
- Country Level Data:
Various factors that are especially aligned to the country are taken into account to determine the market size for a certain area and country, including the presence of vendors, such as headquarters and offices, the country's GDP, demand patterns, and industry growth. To comprehend the market dynamics for the nation, a number of growth variables, inhibitors, application areas, and current market trends are researched. The aforementioned elements aid in determining the country's overall market's growth potential.
- Company Profile:
The “Table of Contents” is formulated by listing and analyzing more than 25 - 30 companies operating in the market ecosystem across geographies. However, we profile only 10 companies as a standard practice in our syndicate reports. These 10 companies comprise leading, emerging, and regional players. Nonetheless, our analysis is not restricted to the 10 listed companies, we also analyze other companies present in the market to develop a holistic view and understand the prevailing trends. The “Company Profiles” section in the report covers key facts, business description, products & services, financial information, SWOT analysis, and key developments. The financial information presented is extracted from the annual reports and official documents of the publicly listed companies. Upon collecting the information for the sections of respective companies, we verify them via various primary sources and then compile the data in respective company profiles. The company level information helps us in deriving the base number as well as in forecasting the market size.
- Developing Base Number:
Aggregation of sales statistics (2020-2022) and macro-economic factor, and other secondary and primary research insights are utilized to arrive at base number and related market shares for 2022. The data gaps are identified in this step and relevant market data is analyzed, collected from paid primary interviews or databases. On finalizing the base year market size, forecasts are developed on the basis of macro-economic, industry and market growth factors and company level analysis.
- Data Triangulation and Final Review:
The market findings and base year market size calculations are validated from supply as well as demand side. Demand side validations are based on macro-economic factor analysis and benchmarks for respective regions and countries. In case of supply side validations, revenues of major companies are estimated (in case not available) based on industry benchmark, approximate number of employees, product portfolio, and primary interviews revenues are gathered. Further revenue from target product/service segment is assessed to avoid overshooting of market statistics. In case of heavy deviations between supply and demand side values, all thes steps are repeated to achieve synchronization.
We follow an iterative model, wherein we share our research findings with Subject Matter Experts (SME’s) and Key Opinion Leaders (KOLs) until consensus view of the market is not formulated – this model negates any drastic deviation in the opinions of experts. Only validated and universally acceptable research findings are quoted in our reports.
We have important check points that we use to validate our research findings – which we call – data triangulation, where we validate the information, we generate from secondary sources with primary interviews and then we re-validate with our internal data bases and Subject matter experts. This comprehensive model enables us to deliver high quality, reliable data in shortest possible time.
 Holen Sie sich ein kostenloses Muster für diesen Bericht
Holen Sie sich ein kostenloses Muster für diesen Bericht