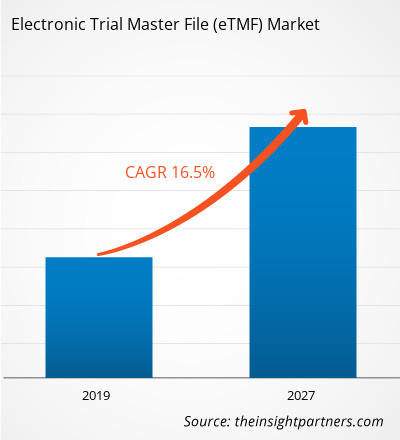
[Informe de investigación] El Archivo Maestro de Ensayos Electrónicos en el mercado de atención médica se valoró en US$ 938,32 millones en 2018 y se proyecta que alcance los US$ 3.155,64 millones para 2027; se espera que crezca a una CAGR del 16,5% entre 2019 y 2027.
Los sistemas de archivo maestro de ensayos electrónicos (eTMF) pueden definirse como una integración de componentes de software y hardware que son colectivamente responsables de la gestión óptima de los datos de ensayos clínicos. Estas soluciones ayudan a agilizar los datos generados durante el transcurso de un ensayo clínico en un formato digital fácil de almacenar, que puede ser recuperado por distintos usuarios, lo que resulta beneficioso en cuanto a la facilidad de acceso y la reducción del costo asociado con las operaciones administrativas y de mantenimiento manual de datos en los ensayos clínicos. El crecimiento del Archivo Maestro de Ensayos Electrónicos en el mercado de la atención médica se atribuye al aumento en el número de ensayos clínicos, la creciente prevalencia de enfermedades y el avance tecnológico que han impulsado el mercado a lo largo de los años. Sin embargo, es probable que la escasez de profesionales capacitados tenga un impacto negativo en el crecimiento del mercado en los próximos años. Por otro lado, es probable que el aumento de las iniciativas estratégicas por parte de los actores del mercado brinde oportunidades de crecimiento en los próximos años.
Se espera que el mercado de los archivos maestros de ensayos electrónicos en el sector sanitario experimente un crecimiento sustancial después de la pandemia. El COVID-19 ha afectado a las economías e industrias de varios países debido a los confinamientos, las prohibiciones de viaje y los cierres de empresas. La crisis del COVID-19 ha sobrecargado los sistemas de salud pública en muchos países y ha puesto de relieve la gran necesidad de una inversión sostenible en los sistemas de salud. A medida que avanza la pandemia del COVID-19, se espera que la industria de la salud experimente una caída en el crecimiento. El segmento de las ciencias de la vida prospera debido a la mayor demanda de productos de diagnóstico in vitro y al aumento de las actividades de investigación y desarrollo en todo el mundo. Sin embargo, el segmento de las tecnologías médicas y la imagenología está experimentando una caída en las ventas debido a la menor cantidad de cirugías que se realizan y a la adquisición de equipos retrasada o prolongada. Además, se espera que las consultas virtuales por parte de los profesionales sanitarios se conviertan en el modelo de prestación de atención sanitaria convencional después de la pandemia. Con la telesalud transformando la prestación de atención, la salud digital seguirá prosperando en los próximos años. Además, también se espera que la interrupción de los ensayos clínicos y el consiguiente retraso en los lanzamientos de medicamentos allanen el camino para ensayos completamente virtuales en el futuro. Se espera que surjan nuevas tecnologías como el ARNm y cambien la industria farmacéutica y el mercado también se espera que sea testigo de una mayor integración vertical y empresas conjuntas en los próximos años.
Personalice este informe según sus necesidades
Obtendrá personalización en cualquier informe, sin cargo, incluidas partes de este informe o análisis a nivel de país, paquete de datos de Excel, así como también grandes ofertas y descuentos para empresas emergentes y universidades.
- Obtenga las principales tendencias clave del mercado de este informe.Esta muestra GRATUITA incluirá análisis de datos, desde tendencias del mercado hasta estimaciones y pronósticos.
Perspectivas del mercado
Las crecientes aplicaciones del archivo maestro de juicios electrónicos en el sector sanitario impulsarán el crecimiento del mercado del archivo maestro de juicios electrónicos en el sector sanitario
La investigación y el desarrollo (I+D) son una parte importante y esencial del negocio de una empresa. Las operaciones de la industria farmacéutica tienen importantes impactos socioeconómicos en la sociedad en forma de inversiones en I+D y fabricación. La investigación y el desarrollo son la "columna vertebral" de cualquier sistema de descubrimiento de fármacos para el éxito, y el archivo maestro de ensayos electrónicos es un software esencial en la investigación y el desarrollo de nuevas entidades terapéuticas basadas en la biotecnología y los productos farmacéuticos. Las empresas farmacéuticas y biotecnológicas se centran principalmente en la investigación y el desarrollo (I+D) para crear nuevas moléculas para diversas aplicaciones terapéuticas con el mayor potencial médico y comercial. Las empresas invierten principalmente en I+D con la intención de ofrecer productos innovadores y de alta calidad al mercado. Por ejemplo, el gasto mundial en I+D en 2017 aumentó un 3,9 por ciento hasta los 165 mil millones de dólares en comparación con 2016. El gasto medio en I+D aumentó moderadamente hasta el 20,9 por ciento como porcentaje de las ventas totales de medicamentos con receta. Además, según una encuesta anual de miembros de PhRMA en 2017 las compañías farmacéuticas informaron haber gastado $71,4 mil millones en investigación y desarrollo.
Las compañías farmacéuticas invirtieron más en I+D para acelerar su proceso de ensayos clínicos. Por ejemplo, al 30 de junio de 2019, AstraZeneca abrió el camino al gastar el 25,63 % de los ingresos en investigación y desarrollo; al 31 de marzo de 2019, Eli Lilly and Company se mantuvo firme, gastando el 22,38 % de sus ingresos en I+D, y al 30 de junio de 2019, Roche Holding AG no se quedó atrás con el 21,29 % gastado en I+D.
Los gastos de investigación y desarrollo suelen producirse durante los procesos de descubrimiento, prueba y desarrollo de nuevos productos, pagos iniciales y etapas de mejora de los resultados existentes, así como para demostrar la eficacia del producto y el cumplimiento normativo antes del lanzamiento. Además, las inversiones en I+D de las empresas farmacéuticas en los EE. UU. han crecido de manera constante durante los últimos 15 años.
El desarrollo y descubrimiento de fármacos es un proceso costoso y que requiere mucho tiempo. El proceso desde la detección temprana o el diseño hasta el desarrollo y la aprobación regulatoria puede llevar más de 10 a 15 años. A lo largo de la fase de desarrollo de una sustancia farmacológica, se requieren varios servicios de prueba para verificar la calidad y la eficacia del producto. Por lo tanto, las empresas farmacéuticas y biotecnológicas prefieren guardar los datos en un archivo maestro electrónico para ahorrar costos y tiempo, lo que se espera que impulse el crecimiento del mercado.
Los ensayos clínicos son uno de los pasos más importantes y significativos en el descubrimiento de fármacos, ya sea que el tratamiento, la estrategia médica o el dispositivo sean seguros y efectivos para uso humano o veterinario. Los estudios clínicos ayudan a comprender y determinar los mejores enfoques de tratamiento para ciertos campos de la terapia. Los ensayos clínicos se realizan específicamente para recopilar datos sobre la seguridad y eficacia del desarrollo de un nuevo producto y herramienta. Antes de que las autoridades regulatorias aprueben las moléculas del fármaco y los dispositivos médicos, se llevan a cabo una serie de estudios clínicos. La creciente prevalencia de varias enfermedades transmisibles y no transmisibles está aumentando la demanda de desarrollo de nuevos fármacos o dispositivos médicos para el tratamiento. Esto, a su vez, se espera que aumente la demanda de actividades de ensayos clínicos para varias áreas terapéuticas.
Las empresas biofarmacéuticas y farmacéuticas que participan en ensayos clínicos tienen como objetivo pasar de los sistemas de gestión de documentos en papel en archivadores a sistemas de gestión de documentos electrónicos en los que los documentos se almacenan en archivos electrónicos en línea. Al implementar un sistema eTMF integral que permite a las organizaciones automatizar, capturar y gestionar documentos y registros de TMF, se corren riesgos innecesarios y, a menudo, se pueden lograr ahorros en los costos de los ensayos clínicos en comparación con los procesos de manejo manual de documentos en papel.
El aumento de la adopción de un sistema de archivo maestro de ensayos electrónicos en el proceso clínico probablemente impulse el mercado. Por ejemplo, NextDocs de Aurea Software es un foro de archivo maestro de ensayos electrónicos (eTMF) para la cooperación clínica en la gestión de registros de ensayos clínicos. Es un sistema de gestión de contenido para la industria farmacéutica que ofrece un medio formalizado de organizar y almacenar documentos, fotografías y otro contenido digital para ensayos farmacéuticos clínicos que pueden requerirse para cumplir con las agencias regulatorias gubernamentales. En los ensayos clínicos, la EMA apoya plenamente el uso de sistemas eTMF para el almacenamiento electrónico como sustituto del papel. La agencia cita problemas de calidad con los TMF y eTMF en una declaración de advertencia debido al contenido en papel e inconsistencias como páginas faltantes, etiquetado inadecuado o documentos incompletos. Debido a las características innovadoras de los eTMF, como la centralización y gestión de la documentación de ensayos clínicos, potentes capacidades de búsqueda (con metadatos) y múltiples métodos para agregar documentos, los eTMF se están volviendo importantes para la eficiencia empresarial, el ahorro de costos y los plazos más cortos para la producción de productos biofarmacéuticos para implementar procesos de gestión electrónica de documentos. El secreto para introducir marcos eTMF interoperables es el uso de un modelo de contenido común, estándares basados en vocabulario y tecnologías de estándares basadas en la web.
Debido al avance del archivo maestro de ensayos a un archivo maestro de ensayos electrónico, las organizaciones de investigación por contrato y las empresas farmacéuticas y de biotecnología están adoptando el eTMF para una mejor gestión de datos clínicos y un mejor proceso de gestión de ensayos clínicos. Las razones y factores mencionados anteriormente se deben a que se debe impulsar el crecimiento del mercado de archivos maestros de ensayos electrónicos.
Información basada en componentes
En términos de componentes, el Archivo Maestro de Ensayos Electrónicos en el mercado de atención médica se segmenta en servicios y software. El segmento de servicios tuvo la mayor participación del mercado en 2019.
Información basada en el modo de entrega
Según el modo de entrega, el Archivo Maestro de Ensayos Electrónicos en el mercado de la atención médica se segmenta en ETMF basado en la nube y ETMF local. El segmento de ETMF basado en la nube tuvo la mayor participación del mercado en 2019.
Información basada en el usuario final
En términos de usuario final, el Archivo Maestro de Ensayos Electrónicos en el mercado de atención médica se segmenta en empresas farmacéuticas y biotecnológicas, CRS y otras. El segmento de empresas farmacéuticas y biotecnológicas tuvo la mayor participación del mercado en 2019.
Los actores del mercado del Archivo Maestro de Ensayos Electrónicos en el sector de la salud están adoptando estrategias de lanzamiento y expansión de productos para satisfacer las cambiantes demandas de los clientes en todo el mundo, lo que también les permite mantener su marca a nivel mundial.
Perspectivas regionales del mercado de archivos maestros de juicios electrónicos (eTMF)
Los analistas de Insight Partners explicaron en detalle las tendencias y los factores regionales que influyen en el mercado de archivos maestros electrónicos de juicios (eTMF) durante el período de pronóstico. Esta sección también analiza los segmentos y la geografía del mercado de archivos maestros electrónicos de juicios (eTMF) en América del Norte, Europa, Asia Pacífico, Oriente Medio y África, y América del Sur y Central.
- Obtenga los datos regionales específicos para el mercado de archivos maestros de juicios electrónicos (eTMF)
Alcance del informe de mercado del archivo maestro de juicios electrónicos (eTMF)
| Atributo del informe | Detalles |
|---|---|
| Tamaño del mercado en 2018 | US$ 938,32 millones |
| Tamaño del mercado en 2027 | US$ 3.155,64 millones |
| Tasa de crecimiento anual compuesta (CAGR) global (2018-2027) | 16,5% |
| Datos históricos | 2016-2017 |
| Período de pronóstico | 2019-2027 |
| Segmentos cubiertos | Por componente
|
| Regiones y países cubiertos | América del norte
|
| Líderes del mercado y perfiles de empresas clave |
|
Densidad de actores del mercado de archivos maestros de juicios electrónicos (eTMF): comprensión de su impacto en la dinámica empresarial
El mercado de archivos maestros de juicios electrónicos (eTMF) está creciendo rápidamente, impulsado por la creciente demanda de los usuarios finales debido a factores como la evolución de las preferencias de los consumidores, los avances tecnológicos y una mayor conciencia de los beneficios del producto. A medida que aumenta la demanda, las empresas amplían sus ofertas, innovan para satisfacer las necesidades de los consumidores y aprovechan las tendencias emergentes, lo que impulsa aún más el crecimiento del mercado.
La densidad de actores del mercado se refiere a la distribución de las empresas o firmas que operan dentro de un mercado o industria en particular. Indica cuántos competidores (actores del mercado) están presentes en un espacio de mercado determinado en relación con su tamaño o valor total de mercado.
Las principales empresas que operan en el mercado de expedientes maestros de juicios electrónicos (eTMF) son:
- Aurea, Inc.
- TRANSPERFECT
- Covance Inc (corporación de laboratorio)
- Oráculo
- Ennov
Descargo de responsabilidad : Las empresas enumeradas anteriormente no están clasificadas en ningún orden particular.
- Obtenga una descripción general de los principales actores clave del mercado del Archivo Maestro de Juicios Electrónicos (eTMF)
Expediente Maestro Electrónico de Ensayos en el Mercado de la Salud – por Componente
- Servicio
- Software
Expediente Maestro de Ensayos Electrónicos en el Mercado de la Salud – por Modo de Entrega
- eTMF basado en la nube
- eTMF local
Expediente Maestro de Ensayos Electrónicos en el Mercado de la Salud – por Usuario Final
- Empresas farmacéuticas y biotecnológicas
- Organizaciones de investigación por contrato (CRO)
- Otros
Expediente maestro de ensayos electrónicos en el mercado de la atención sanitaria, por geografía
América del norte
- A NOSOTROS
- Canadá
- México
Europa
- Francia
- Alemania
- Italia
- Reino Unido
- España
- Resto de Europa
Asia Pacífico (APAC)
- Porcelana
- India
- Corea del Sur
- Japón
- Australia
- Resto de APAC
Oriente Medio y África (MEA)
- Sudáfrica
- Arabia Saudita
- Emiratos Árabes Unidos
- Resto de MEA
América del Sur y América Central (SCAM)
- Brasil
- Argentina
- Resto de estafa
Perfiles de empresas
- Aurea, Inc.
- Transperfecto.
- Covance Inc (corporación de laboratorio)
- Oráculo
- Ennov
- Control maestro, Inc.
- Omnicomunicación
- Farmacovigilancia
- Sistemas Veeva
- Phlexglobal
- Análisis histórico (2 años), año base, pronóstico (7 años) con CAGR
- Análisis PEST y FODA
- Tamaño del mercado Valor/volumen: global, regional, nacional
- Industria y panorama competitivo
- Conjunto de datos de Excel

Report Coverage
Revenue forecast, Company Analysis, Industry landscape, Growth factors, and Trends
Segment Covered
This text is related
to segments covered.

Regional Scope
North America, Europe, Asia Pacific, Middle East & Africa, South & Central America
Country Scope
This text is related
to country scope.
Preguntas frecuentes
Pharmaceutical and biotechnology companies, contract research organizations (CROs) and other users can make use of electronic trial master file (eTMF).
Increasing in number of clinical trial, increasing prevalence of diseases and technology advancement have been boosting the market over the years. However, dearth of skilled professionals is likely to have a negative impact on the growth of the market in the coming years. On the other hand, increasing strategic initiatives by market players is likely to provide growth opportunities over the coming years.
Electronic trial master file (eTMF) systems can be defined as an integration of software and hardware components collectively responsible for the optimal management of clinical trial data. These solutions help to streamline the data generated during the course of a clinical trial in an easy-to-store digital format, which can be retrieved by dissimilar users beneficial in easy accessibility and reduction the cost associated with the administrative and manual data maintenance operations in clinical trials.
Trends and growth analysis reports related to Technology, Media and Telecommunications : READ MORE..
The List of Companies - Electronic Trial Master File (eTMF) Market
- Aurea, Inc.
- TRANSPERFECT
- Covance Inc (Lab Corp)
- Oracle
- Ennov
- Mastercontrol, Inc.
- Omnicomm
- Pharmavigilalnce
- Veeva Systems
- Phlexglobal
The Insight Partners performs research in 4 major stages: Data Collection & Secondary Research, Primary Research, Data Analysis and Data Triangulation & Final Review.
- Data Collection and Secondary Research:
As a market research and consulting firm operating from a decade, we have published and advised several client across the globe. First step for any study will start with an assessment of currently available data and insights from existing reports. Further, historical and current market information is collected from Investor Presentations, Annual Reports, SEC Filings, etc., and other information related to company’s performance and market positioning are gathered from Paid Databases (Factiva, Hoovers, and Reuters) and various other publications available in public domain.
Several associations trade associates, technical forums, institutes, societies and organization are accessed to gain technical as well as market related insights through their publications such as research papers, blogs and press releases related to the studies are referred to get cues about the market. Further, white papers, journals, magazines, and other news articles published in last 3 years are scrutinized and analyzed to understand the current market trends.
- Primary Research:
The primarily interview analysis comprise of data obtained from industry participants interview and answers to survey questions gathered by in-house primary team.
For primary research, interviews are conducted with industry experts/CEOs/Marketing Managers/VPs/Subject Matter Experts from both demand and supply side to get a 360-degree view of the market. The primary team conducts several interviews based on the complexity of the markets to understand the various market trends and dynamics which makes research more credible and precise.
A typical research interview fulfils the following functions:
- Provides first-hand information on the market size, market trends, growth trends, competitive landscape, and outlook
- Validates and strengthens in-house secondary research findings
- Develops the analysis team’s expertise and market understanding
Primary research involves email interactions and telephone interviews for each market, category, segment, and sub-segment across geographies. The participants who typically take part in such a process include, but are not limited to:
- Industry participants: VPs, business development managers, market intelligence managers and national sales managers
- Outside experts: Valuation experts, research analysts and key opinion leaders specializing in the electronics and semiconductor industry.
Below is the breakup of our primary respondents by company, designation, and region:
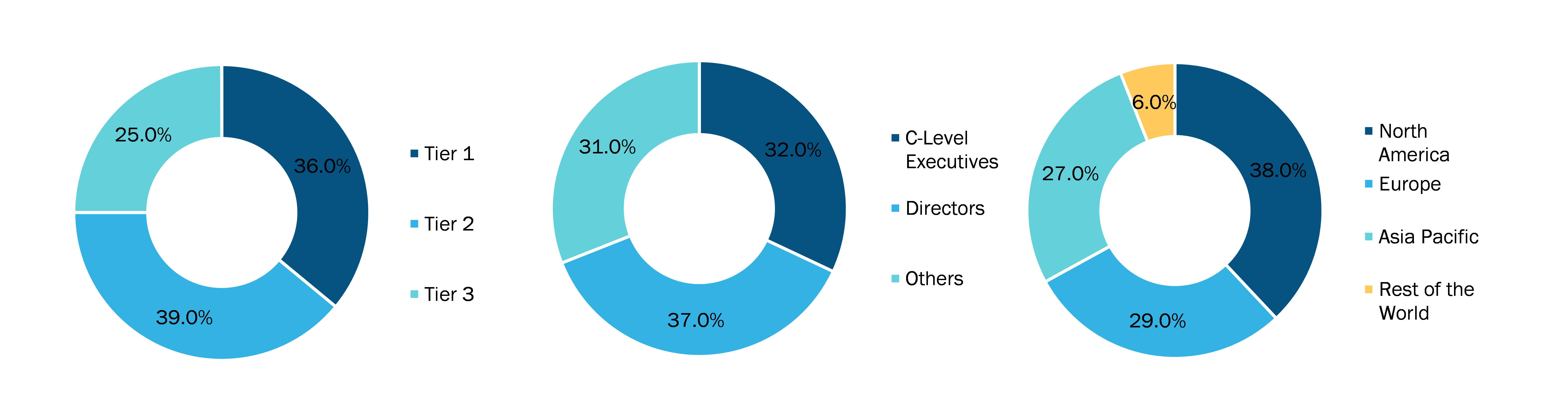
Once we receive the confirmation from primary research sources or primary respondents, we finalize the base year market estimation and forecast the data as per the macroeconomic and microeconomic factors assessed during data collection.
- Data Analysis:
Once data is validated through both secondary as well as primary respondents, we finalize the market estimations by hypothesis formulation and factor analysis at regional and country level.
- Macro-Economic Factor Analysis:
We analyse macroeconomic indicators such the gross domestic product (GDP), increase in the demand for goods and services across industries, technological advancement, regional economic growth, governmental policies, the influence of COVID-19, PEST analysis, and other aspects. This analysis aids in setting benchmarks for various nations/regions and approximating market splits. Additionally, the general trend of the aforementioned components aid in determining the market's development possibilities.
- Country Level Data:
Various factors that are especially aligned to the country are taken into account to determine the market size for a certain area and country, including the presence of vendors, such as headquarters and offices, the country's GDP, demand patterns, and industry growth. To comprehend the market dynamics for the nation, a number of growth variables, inhibitors, application areas, and current market trends are researched. The aforementioned elements aid in determining the country's overall market's growth potential.
- Company Profile:
The “Table of Contents” is formulated by listing and analyzing more than 25 - 30 companies operating in the market ecosystem across geographies. However, we profile only 10 companies as a standard practice in our syndicate reports. These 10 companies comprise leading, emerging, and regional players. Nonetheless, our analysis is not restricted to the 10 listed companies, we also analyze other companies present in the market to develop a holistic view and understand the prevailing trends. The “Company Profiles” section in the report covers key facts, business description, products & services, financial information, SWOT analysis, and key developments. The financial information presented is extracted from the annual reports and official documents of the publicly listed companies. Upon collecting the information for the sections of respective companies, we verify them via various primary sources and then compile the data in respective company profiles. The company level information helps us in deriving the base number as well as in forecasting the market size.
- Developing Base Number:
Aggregation of sales statistics (2020-2022) and macro-economic factor, and other secondary and primary research insights are utilized to arrive at base number and related market shares for 2022. The data gaps are identified in this step and relevant market data is analyzed, collected from paid primary interviews or databases. On finalizing the base year market size, forecasts are developed on the basis of macro-economic, industry and market growth factors and company level analysis.
- Data Triangulation and Final Review:
The market findings and base year market size calculations are validated from supply as well as demand side. Demand side validations are based on macro-economic factor analysis and benchmarks for respective regions and countries. In case of supply side validations, revenues of major companies are estimated (in case not available) based on industry benchmark, approximate number of employees, product portfolio, and primary interviews revenues are gathered. Further revenue from target product/service segment is assessed to avoid overshooting of market statistics. In case of heavy deviations between supply and demand side values, all thes steps are repeated to achieve synchronization.
We follow an iterative model, wherein we share our research findings with Subject Matter Experts (SME’s) and Key Opinion Leaders (KOLs) until consensus view of the market is not formulated – this model negates any drastic deviation in the opinions of experts. Only validated and universally acceptable research findings are quoted in our reports.
We have important check points that we use to validate our research findings – which we call – data triangulation, where we validate the information, we generate from secondary sources with primary interviews and then we re-validate with our internal data bases and Subject matter experts. This comprehensive model enables us to deliver high quality, reliable data in shortest possible time.

 Obtenga una muestra gratuita de este informe
Obtenga una muestra gratuita de este informe