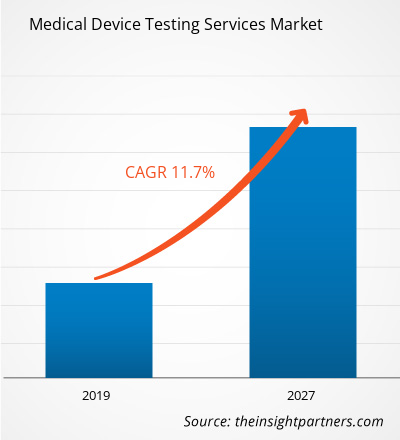
Los servicios de pruebas de dispositivos médicos en el mercado de atención médica se valoraron en US$ 5505,4 millones en 2018 y se proyecta que alcancen los US$ 14.660,1 millones para 2027; se espera que crezca a una CAGR del 11,7% entre 2019 y 2027.
Los dispositivos médicos son muy importantes, ya que tienen un impacto directo en la vida del paciente. Para ofrecer experiencias seguras y de alta calidad a los pacientes, los fabricantes de dispositivos médicos prueban los dispositivos médicos antes de entregarlos al mercado. Los fabricantes de dispositivos médicos prefieren realizar pruebas internas o subcontratar los servicios de prueba a las organizaciones de investigación por contrato (CRO) para cumplir con las estrictas pautas regulatorias. La prueba de los dispositivos médicos es para garantizar la seguridad, la calidad y la consistencia del servicio durante todas las etapas de desarrollo y uso del dispositivo médico. El tratamiento médico depende en gran medida de los dispositivos médicos, por lo tanto, es importante asegurarse de que la prueba de los dispositivos médicos se realice con la máxima competencia. El crecimiento de los servicios de prueba de dispositivos médicos en el mercado de la atención médica se atribuye al desarrollo de productos innovadores, colaboraciones, fusiones y adquisiciones, el estricto escenario regulatorio para la aprobación de dispositivos médicos está impulsando el crecimiento del mercado a lo largo de los años. Además, es probable que los desarrollos en la industria de dispositivos médicos tengan un impacto positivo en la demanda del mercado durante el período de pronóstico. Sin embargo, el crecimiento del mercado está restringido por factores como las interrupciones en las obligaciones contractuales.
Se espera que el mercado de servicios de pruebas de dispositivos médicos en el cuidado de la salud sea testigo de un crecimiento sustancial después de la pandemia. SGS SA, Eurofins, Toxikon, Pace Analytical Services, LLC, Intertek Group plc, NORTH AMERICAN SCIENCE ASSOCIATES INC., Charles River, WuXi AppTec, Element Materials Technology, TÜV SÜD AG Se espera que el ARNm surja y cambie la industria farmacéutica y también se espera que el mercado sea testigo de una mayor integración vertical y empresas conjuntas en los próximos años.
Perspectivas del mercado
Las crecientes aplicaciones de los servicios de pruebas de dispositivos médicos en el sector sanitario impulsarán el crecimiento del mercado de dichos servicios
Personalice este informe según sus necesidades
Obtendrá personalización en cualquier informe, sin cargo, incluidas partes de este informe o análisis a nivel de país, paquete de datos de Excel, así como también grandes ofertas y descuentos para empresas emergentes y universidades.
- Obtenga las principales tendencias clave del mercado de este informe.Esta muestra GRATUITA incluirá análisis de datos, desde tendencias del mercado hasta estimaciones y pronósticos.
Las pruebas de dispositivos médicos requieren una sólida experiencia en el campo, en las legislaciones locales y nacionales, e información sobre los dispositivos, la infraestructura y la capacidad para respaldar las pruebas. La industria de la atención médica y los dispositivos médicos es activa debido al desarrollo continuo y a las soluciones avanzadas. Las mejoras en la tecnología de los dispositivos médicos han mejorado significativamente la eficiencia de la atención al paciente en las últimas décadas.
Sin embargo, los fabricantes de diversos dispositivos médicos a veces enfrentan desafíos a la hora de preparar productos para el mercado. Las regulaciones son a veces complejas y difíciles de entender, sobre todo cuando se relacionan con aplicaciones de dispositivos médicos innovadores y novedosos.
Un retiro del mercado es un proceso de eliminación o modificación de productos que no cumplen con las leyes administradas por la Administración de Alimentos y Medicamentos (FDA). La mayoría de los retiros de dispositivos médicos los realiza voluntariamente la empresa de conformidad con el artículo 21 CFR 7. La FDA clasifica los retiros de productos en varias designaciones, como I, II o III, para indicar el grado comparativo de riesgo para la salud que ofrece el producto que se retira.
Según la FDA, en 2018 se han identificado más de 80.000 incidentes desde 2008 debido a lesiones causadas por dispositivos médicos. En los últimos años, las empresas de dispositivos médicos y los médicos han observado que los estimuladores de la médula espinal han ayudado a los pacientes que sufren trastornos de dolor. Debido a esto, se ha convertido en uno de los productos de mayor crecimiento en la industria de dispositivos médicos de 400 mil millones de dólares. Por lo tanto, la creciente incidencia de retiradas de productos y la mayor demanda de productos de calidad están aumentando la necesidad de realizar pruebas de dispositivos médicos. Por lo tanto, impulsará el mercado de servicios de prueba de dispositivos médicos.
La tecnología de dispositivos médicos está mejorando la vida al identificar enfermedades en una etapa temprana y mejorar el tratamiento, el diagnóstico y el seguimiento del paciente. Los programas de capacitación para pequeñas y medianas empresas (PYME) se han implementado en países como China, Chile, Indonesia, México, Malasia, Singapur, Filipinas, Perú, Rusia y Vietnam, entre otros. En 2018, el mercado de dispositivos médicos en el Reino Unido estaba valorado en aproximadamente US$10.6 mil millones. Entre los cuales, alrededor de 2.500 son empresas de dispositivos médicos de tamaño pequeño a mediano en el Reino Unido. Además, un gran número de empresas multinacionales han establecido sus sedes centrales o subsidiarias en el país. Además, cada año, los fideicomisos agudos gastan alrededor de un promedio de US$6.6 mil millones en suministros clínicos, que incluyen equipos médicos.
Además, en 2018, la Administración de Comercio Internacional (ITA) mencionó que hay más de 1.300 empresas de dispositivos médicos en Francia, de las cuales un tercio de todas las empresas de dispositivos médicos son empresas extranjeras. Sin embargo, estas empresas extranjeras de dispositivos médicos representan alrededor de dos tercios del negocio total.
Además, de las 1.300 empresas de dispositivos médicos en Francia, aproximadamente el 92% son pequeñas y medianas empresas (PYME), de las cuales el 88% producen exclusivamente dispositivos médicos. Las PYME subcontratan las pruebas de los dispositivos médicos, ya que requieren un alto coste, tiempo y mano de obra calificada.
Además, en Madrid y Cataluña se concentra más del 80 por ciento de las ventas de dispositivos médicos. De ellos, el 90 por ciento del mercado de dispositivos médicos son pequeñas y medianas empresas que generan alrededor del 40 por ciento de los ingresos totales de dispositivos médicos. Dado que estas empresas son empresas emergentes, optan por subcontratar las pruebas de dispositivos médicos para reducir el costo y ahorrar tiempo. Por lo tanto, es probable que la creciente necesidad en la industria impulse el crecimiento del mercado mundial de servicios de pruebas de dispositivos médicos en los próximos años. Ofrecer tecnología avanzada de dispositivos médicos a los consumidores es una prioridad.
- Esta muestra GRATUITA incluirá análisis de datos, desde tendencias del mercado hasta estimaciones y pronósticos.
Proyecto de riesgo. Por lo tanto, las empresas ofrecen pruebas correctas al proporcionar resultados precisos y confiables para los requisitos de prueba de dispositivos médicos, desde pequeñas empresas emergentes hasta grandes fabricantes establecidos.
Muchos laboratorios en América del Norte, Europa y Asia Pacífico ofrecen conocimientos de cumplimiento normativo y pruebas calificadas GMP/GLP/ISO 17025 para garantizar tiempos de mejora rápidos utilizando el más alto nivel de servicio y las tecnologías más avanzadas para los requisitos de pruebas microbiológicas, químicas analíticas, de biocompatibilidad y de paquetes.
En otros países existen diversos organismos reguladores que regulan los dispositivos médicos. En España, los dispositivos médicos están controlados y autorizados por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). La Ley de Alimentos y Medicamentos (FDA) establece un marco regulatorio para numerosos dispositivos médicos. La Oficina de Dispositivos Médicos es otro organismo responsable de las directrices sobre dispositivos médicos que permiten la venta e importación de dispositivos médicos.
Todos los dispositivos médicos tienen un conjunto exclusivo y sistemático de requisitos de prueba impuestos por la FDA, la Administración de Alimentos y Medicamentos de China (CFDA), los organismos notificados de la UE y otros organismos reguladores, que deben seguirse antes de ingresar al mercado.
En Canadá, Health Canada implementó la notificación obligatoria de incidentes de dispositivos médicos por parte de importadores y fabricantes y también inspira la presentación de informes por parte de profesionales de la salud, hospitales y consumidores/pacientes. En México, la COFEPRIS es responsable de la aprobación y el registro del dispositivo médico. El fabricante debe cumplir con todos los requisitos de prueba y cumplir con la solicitud de aprobación de la COFEPRIS.
La Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA) es la autoridad encargada de administrar la legislación sobre dispositivos médicos en el Reino Unido. Inspecciona los productos sanitarios con problemas potenciales y garantiza su seguridad y calidad. En Japón, son el Ministerio de Salud, Trabajo y Bienestar (MHLW) y la Agencia de Productos Farmacéuticos y Dispositivos Médicos (PMDA) los que trabajan juntos para realizar pruebas científicas de los dispositivos médicos destinados a su comercialización con el fin de supervisar su seguridad posterior a la comercialización.
Por lo tanto, se espera que las crecientes regulaciones estrictas para dispositivos innovadores y precisos impulsen el crecimiento del mercado de servicios de pruebas de dispositivos médicos durante el período de pronóstico.
Perspectivas basadas en servicios
En términos de servicio, los servicios de prueba de dispositivos médicos en el mercado de atención médica se segmentan en pruebas de biocompatibilidad, pruebas químicas, pruebas de microbiología y esterilidad y validación de paquetes. En 2018, las pruebas de microbiología y esterilidad tuvieron la participación de mercado más significativa, con un 53,55 % del mercado de servicios de prueba de dispositivos médicos, por servicio.
Perspectivas regionales del mercado de servicios de pruebas de dispositivos médicos
Los analistas de Insight Partners explicaron en detalle las tendencias y los factores regionales que influyen en el mercado de servicios de prueba de dispositivos médicos durante el período de pronóstico. Esta sección también analiza los segmentos y la geografía del mercado de servicios de prueba de dispositivos médicos en América del Norte, Europa, Asia Pacífico, Oriente Medio y África, y América del Sur y Central.
- Obtenga datos regionales específicos para el mercado de servicios de prueba de dispositivos médicos
Alcance del informe de mercado de servicios de pruebas de dispositivos médicos
| Atributo del informe | Detalles |
|---|---|
| Tamaño del mercado en 2018 | 5.51 mil millones de dólares estadounidenses |
| Tamaño del mercado en 2027 | US$ 14,66 mil millones |
| Tasa de crecimiento anual compuesta (CAGR) global (2018-2027) | 11,7% |
| Datos históricos | 2016-2017 |
| Período de pronóstico | 2019-2027 |
| Segmentos cubiertos | Por servicio
|
| Regiones y países cubiertos | América del norte
|
| Líderes del mercado y perfiles de empresas clave |
|
Densidad de actores del mercado de servicios de pruebas de dispositivos médicos: comprensión de su impacto en la dinámica empresarial
El mercado de servicios de prueba de dispositivos médicos está creciendo rápidamente, impulsado por la creciente demanda de los usuarios finales debido a factores como la evolución de las preferencias de los consumidores, los avances tecnológicos y una mayor conciencia de los beneficios del producto. A medida que aumenta la demanda, las empresas amplían sus ofertas, innovan para satisfacer las necesidades de los consumidores y aprovechan las tendencias emergentes, lo que impulsa aún más el crecimiento del mercado.
La densidad de actores del mercado se refiere a la distribución de las empresas o firmas que operan dentro de un mercado o industria en particular. Indica cuántos competidores (actores del mercado) están presentes en un espacio de mercado determinado en relación con su tamaño o valor total de mercado.
Las principales empresas que operan en el mercado de servicios de pruebas de dispositivos médicos son:
- SGS SA
- Eurofins
- Toxicon
- Servicios analíticos Pace, LLC
- Grupo Intertek plc
Descargo de responsabilidad : Las empresas enumeradas anteriormente no están clasificadas en ningún orden particular.
- Obtenga una descripción general de los principales actores clave del mercado de servicios de pruebas de dispositivos médicos
Perspectivas basadas en fases
Según la fase, los servicios de prueba de dispositivos médicos en el mercado de atención médica se segmentan en preclínicos y clínicos. En 2018, el segmento preclínico tenía una participación de mercado considerable del 68,17 % del mercado de servicios de prueba de dispositivos médicos, por fase.
Los actores del mercado de servicios de pruebas de dispositivos médicos en el cuidado de la salud están adoptando estrategias de lanzamiento y expansión de productos para satisfacer las cambiantes demandas de los clientes en todo el mundo, lo que también les permite mantener su marca a nivel mundial.
Servicios de prueba de dispositivos médicos en el mercado de la atención médica: por servicio
- Prueba de biocompatibilidad
- Prueba de química
- Microbiología y pruebas de esterilidad
- Validación de paquetes
Servicios de pruebas de dispositivos médicos en el mercado de la atención sanitaria: por fase
- Preclínico
- Clínico
Servicios de prueba de dispositivos médicos en el mercado de la atención sanitaria, por geografía
América del norte
- A NOSOTROS
- Canadá
- México
Europa
- Francia
- Alemania
- Italia
- Reino Unido
- España
- Resto de Europa
Asia Pacífico (APAC)
- Porcelana
- India
- Corea del Sur
- Japón
- Australia
- Resto de APAC
Oriente Medio y África (MEA)
- Sudáfrica
- Arabia Saudita
- Emiratos Árabes Unidos
- Resto de MEA
América del Sur y América Central (SCAM)
- Brasil
- Argentina
- Resto de estafa
Perfiles de empresas
- SGS SA
- Eurofins
- Toxicon
- Servicios analíticos Pace, LLC
- Grupo Intertek plc
- ASOCIADOS CIENTÍFICOS DE AMERICA DEL NORTE INC.
- Río Charles
- Tecnología de aplicaciones WuXi
- Tecnología de materiales de elementos
- TÜV SÜD AG
- Análisis histórico (2 años), año base, pronóstico (7 años) con CAGR
- Análisis PEST y FODA
- Tamaño del mercado Valor/volumen: global, regional, nacional
- Industria y panorama competitivo
- Conjunto de datos de Excel

Report Coverage
Revenue forecast, Company Analysis, Industry landscape, Growth factors, and Trends
Segment Covered
This text is related
to segments covered.

Regional Scope
North America, Europe, Asia Pacific, Middle East & Africa, South & Central America
Country Scope
This text is related
to country scope.
Trends and growth analysis reports related to Life Sciences : READ MORE..
The List of Companies
- SGS SA
- Eurofins
- Toxikon
- Pace Analytical Services, LLC
- Intertek Group plc
- NORTH AMERICAN SCIENCE ASSOCIATES INC.
- Charles River
- WuXi AppTec
- Element Materials Technology
- TÜV SÜD AG
The Insight Partners performs research in 4 major stages: Data Collection & Secondary Research, Primary Research, Data Analysis and Data Triangulation & Final Review.
- Data Collection and Secondary Research:
As a market research and consulting firm operating from a decade, we have published and advised several client across the globe. First step for any study will start with an assessment of currently available data and insights from existing reports. Further, historical and current market information is collected from Investor Presentations, Annual Reports, SEC Filings, etc., and other information related to company’s performance and market positioning are gathered from Paid Databases (Factiva, Hoovers, and Reuters) and various other publications available in public domain.
Several associations trade associates, technical forums, institutes, societies and organization are accessed to gain technical as well as market related insights through their publications such as research papers, blogs and press releases related to the studies are referred to get cues about the market. Further, white papers, journals, magazines, and other news articles published in last 3 years are scrutinized and analyzed to understand the current market trends.
- Primary Research:
The primarily interview analysis comprise of data obtained from industry participants interview and answers to survey questions gathered by in-house primary team.
For primary research, interviews are conducted with industry experts/CEOs/Marketing Managers/VPs/Subject Matter Experts from both demand and supply side to get a 360-degree view of the market. The primary team conducts several interviews based on the complexity of the markets to understand the various market trends and dynamics which makes research more credible and precise.
A typical research interview fulfils the following functions:
- Provides first-hand information on the market size, market trends, growth trends, competitive landscape, and outlook
- Validates and strengthens in-house secondary research findings
- Develops the analysis team’s expertise and market understanding
Primary research involves email interactions and telephone interviews for each market, category, segment, and sub-segment across geographies. The participants who typically take part in such a process include, but are not limited to:
- Industry participants: VPs, business development managers, market intelligence managers and national sales managers
- Outside experts: Valuation experts, research analysts and key opinion leaders specializing in the electronics and semiconductor industry.
Below is the breakup of our primary respondents by company, designation, and region:
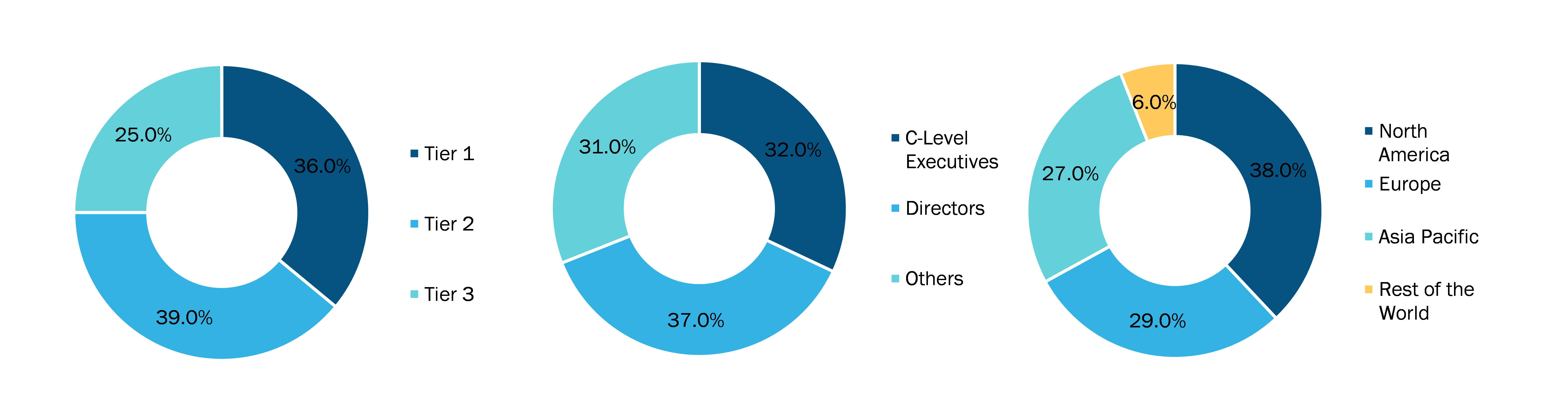
Once we receive the confirmation from primary research sources or primary respondents, we finalize the base year market estimation and forecast the data as per the macroeconomic and microeconomic factors assessed during data collection.
- Data Analysis:
Once data is validated through both secondary as well as primary respondents, we finalize the market estimations by hypothesis formulation and factor analysis at regional and country level.
- Macro-Economic Factor Analysis:
We analyse macroeconomic indicators such the gross domestic product (GDP), increase in the demand for goods and services across industries, technological advancement, regional economic growth, governmental policies, the influence of COVID-19, PEST analysis, and other aspects. This analysis aids in setting benchmarks for various nations/regions and approximating market splits. Additionally, the general trend of the aforementioned components aid in determining the market's development possibilities.
- Country Level Data:
Various factors that are especially aligned to the country are taken into account to determine the market size for a certain area and country, including the presence of vendors, such as headquarters and offices, the country's GDP, demand patterns, and industry growth. To comprehend the market dynamics for the nation, a number of growth variables, inhibitors, application areas, and current market trends are researched. The aforementioned elements aid in determining the country's overall market's growth potential.
- Company Profile:
The “Table of Contents” is formulated by listing and analyzing more than 25 - 30 companies operating in the market ecosystem across geographies. However, we profile only 10 companies as a standard practice in our syndicate reports. These 10 companies comprise leading, emerging, and regional players. Nonetheless, our analysis is not restricted to the 10 listed companies, we also analyze other companies present in the market to develop a holistic view and understand the prevailing trends. The “Company Profiles” section in the report covers key facts, business description, products & services, financial information, SWOT analysis, and key developments. The financial information presented is extracted from the annual reports and official documents of the publicly listed companies. Upon collecting the information for the sections of respective companies, we verify them via various primary sources and then compile the data in respective company profiles. The company level information helps us in deriving the base number as well as in forecasting the market size.
- Developing Base Number:
Aggregation of sales statistics (2020-2022) and macro-economic factor, and other secondary and primary research insights are utilized to arrive at base number and related market shares for 2022. The data gaps are identified in this step and relevant market data is analyzed, collected from paid primary interviews or databases. On finalizing the base year market size, forecasts are developed on the basis of macro-economic, industry and market growth factors and company level analysis.
- Data Triangulation and Final Review:
The market findings and base year market size calculations are validated from supply as well as demand side. Demand side validations are based on macro-economic factor analysis and benchmarks for respective regions and countries. In case of supply side validations, revenues of major companies are estimated (in case not available) based on industry benchmark, approximate number of employees, product portfolio, and primary interviews revenues are gathered. Further revenue from target product/service segment is assessed to avoid overshooting of market statistics. In case of heavy deviations between supply and demand side values, all thes steps are repeated to achieve synchronization.
We follow an iterative model, wherein we share our research findings with Subject Matter Experts (SME’s) and Key Opinion Leaders (KOLs) until consensus view of the market is not formulated – this model negates any drastic deviation in the opinions of experts. Only validated and universally acceptable research findings are quoted in our reports.
We have important check points that we use to validate our research findings – which we call – data triangulation, where we validate the information, we generate from secondary sources with primary interviews and then we re-validate with our internal data bases and Subject matter experts. This comprehensive model enables us to deliver high quality, reliable data in shortest possible time.

 Obtenga una muestra gratuita de este informe
Obtenga una muestra gratuita de este informe