Se espera que el tamaño del mercado de software de farmacovigilancia y seguridad de medicamentos alcance los 359,30 millones de dólares estadounidenses en 2031, frente a los 214,39 millones de dólares estadounidenses en 2023. Se estima que el mercado registrará una CAGR del 6,7 % durante el período 2023-2031. Es probable que el software de farmacovigilancia y seguridad de medicamentos basado en la nube traiga nuevas tendencias clave al mercado en los próximos años.
Análisis del mercado de software de farmacovigilancia y seguridad de medicamentos
La creciente integración de tecnologías como la inteligencia artificial y el aprendizaje automático con el software de farmacovigilancia y seguridad de medicamentos para automatizar las tareas de seguridad de medicamentos está impulsando el mercado. Varios actores clave están integrando estas tecnologías avanzadas para automatizar el flujo de trabajo en la industria farmacéutica. Por ejemplo, en enero de 2024, PubHive Ltd., un proveedor de flujos de trabajo de información bibliográfica y de seguridad científica impulsados por IA, lanzó un software de gestión centralizada de Resumen de las características del producto (RCP) con flujos de trabajo de farmacovigilancia impulsados por IA para empresas de ciencias biológicas. La empresa ofrece su software a las organizaciones de investigación clínica (CRO) y sus departamentos de farmacovigilancia y seguridad de medicamentos. Esta solución basada en IA simplifica y agiliza los procesos y ayuda a cumplir con los requisitos, además de permitir que los equipos de farmacovigilancia trabajen más rápido y de manera más eficaz.
Descripción general del mercado de software de farmacovigilancia y seguridad de medicamentos
El software de farmacovigilancia y seguridad de medicamentos es una herramienta vital que aborda los errores de entrada manual de datos y gestiona el enorme volumen de datos de seguridad, entre otros desafíos. Desde los ensayos clínicos hasta la vigilancia posterior a la comercialización, este software es indispensable durante todo el ciclo de vida del desarrollo de medicamentos. El software de farmacovigilancia y seguridad de medicamentos ayuda a reducir el tiempo de procesamiento de eventos adversos y mejora la seguridad del paciente mediante la detección temprana de señales. A medida que evolucionan las regulaciones y se intensifica la colaboración entre las empresas europeas, la adopción de software de farmacovigilancia y seguridad de medicamentos se volverá imperativa para las empresas farmacéuticas y los organismos reguladores. En 2022, el Esquema de Cooperación de Inspección Farmacéutica (PIC/S) actualizó sus pautas sobre farmacovigilancia para cumplir con los estándares internacionales, destacando la importancia de un software sólido de farmacovigilancia y seguridad de medicamentos. Además, en marzo de 2024, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) proporcionó una guía que especifica la presentación de informes de seguridad de nuevos medicamentos en investigación (IND) para eventos adversos graves y sospechosos relacionados con medicamentos farmacéuticos. Estos informes se envían en formatos electrónicos de documento técnico común (eCTD) utilizando archivos PDF. Además, el software garantiza el cumplimiento de los estándares regulatorios al facilitar la creación de informes de seguridad completos y presentaciones a las autoridades reguladoras, lo que ayuda a las empresas a evitar sanciones y mantener su reputación.
Personalice la investigación para adaptarla a sus necesidades
Podemos optimizar y adaptar el análisis y el alcance que no se alcanzan con nuestras ofertas estándar. Esta flexibilidad le ayudará a obtener la información exacta que necesita para la planificación y la toma de decisiones de su negocio.
Mercado de software de farmacovigilancia y seguridad de medicamentos: perspectivas estratégicas
Tasa de crecimiento anual compuesta (2023-2031)6,7%- Tamaño del mercado 2023
US$ 214,39 millones - Tamaño del mercado 2031
US$ 359,30 millones

Dinámica del mercado
- Aumento de la incidencia de reacciones adversas a medicamentos
- Globalización de la farmacovigilancia
- Aumento del gasto en el desarrollo de medicamentos
- Farmacovigilancia basada en la nube
- Software de seguridad de medicamentos
- Integración de software con IA y ML
- PNL
Actores clave
- Aris Europa
- ICONO plc
- Salud Syneos
- Accenture
- IQVIA
- Pacto Genético
- Competente
- Corporación Paraxel Internacional
- Corporación de laboratorio de América Holdings
- Aplicación máxima
Panorama regional
- América del norte
- Europa
- Asia-Pacífico
- América del Sur y Central
- Oriente Medio y África
Segmentación del mercado
 Ofrenda
Ofrenda- Software
- Servicios
 Despliegue
Despliegue- Nube
- En las instalaciones
 Tamaño de la empresa
Tamaño de la empresa- Grandes empresas
- PYMES
 Forma
Forma- Estándar
- Personalizado
- El PDF de muestra muestra la estructura del contenido y la naturaleza de la información con análisis cualitativo y cuantitativo.
Factores impulsores y oportunidades del mercado de software de farmacovigilancia y seguridad de medicamentos
El aumento de las incidencias de reacciones adversas a medicamentos favorece al mercado
Los casos de reacciones adversas a medicamentos (RAM) están aumentando en todo el mundo debido a la creciente prevalencia de enfermedades crónicas . Como todos los medicamentos tienen el potencial de producir reacciones adversas a medicamentos, es necesario un análisis de riesgo-beneficio siempre que se prescribe un medicamento. Las RAM siguen siendo un desafío en la atención médica moderna, en particular dada la creciente complejidad de las terapias, el envejecimiento de la población y el aumento de la multimorbilidad en todo el mundo. El software de farmacovigilancia permite a los proveedores de atención médica y a las empresas farmacéuticas recopilar, analizar sistemáticamente y notificar datos relacionados con las RAM y superar los desafíos asociados con ellas. La creciente prevalencia de las RAM en todo el mundo está impulsando la demanda de software de farmacovigilancia y seguridad de los medicamentos. Según la base de datos de RAM disponible en el Sistema de notificación de eventos adversos (FAERS) de la Administración de Alimentos y Medicamentos de los EE. UU., en 2022 se notificaron más de 1,25 millones de casos adversos graves, junto con más de 175 000 muertes.
Las reacciones adversas a medicamentos son una de las principales causas de la creciente tasa de mortalidad en todo el mundo. Según el informe de la Agencia Europea de Medicamentos (EUDA), en términos de sobredosis, la tasa de mortalidad en la Unión Europea en 2021 fue de aproximadamente 18,3 muertes por millón de personas de entre 15 y 64 años. Además, en 2021 se produjeron en la Unión Europea al menos 6166 muertes causadas por sobredosis de drogas ilícitas (5796 en 2020). Este total alcanzó las 6677 muertes si se incluyen Noruega y Turquía (6434 en 2020).
La exposición a la teofilina y la depresión respiratoria aumentan con el uso de antibióticos macrólidos y el aumento del consumo de vitamina K, lo que conduce a reacciones adversas a medicamentos. A medida que se notifican y reconocen más reacciones adversas a medicamentos, las empresas farmacéuticas, los proveedores de atención médica y los organismos reguladores enfrentan una mayor presión para mejorar los procesos de monitoreo y notificación de la seguridad de los medicamentos. El software de farmacovigilancia y seguridad de medicamentos ayuda a evitar los riesgos asociados con el consumo excesivo de medicamentos. Este software ayuda a agilizar el proceso de detección, evaluación y prevención de efectos adversos, lo que permite tiempos de respuesta más rápidos y evaluaciones de riesgos más precisas. Por lo tanto, la creciente incidencia de reacciones adversas a medicamentos impulsa el crecimiento del mercado mundial de software de farmacovigilancia y seguridad de medicamentos .
Globalización de la farmacovigilancia
La farmacovigilancia es el proceso de seguimiento y evaluación de las reacciones adversas a los medicamentos y es un componente importante de los sistemas eficaces de regulación de medicamentos, la práctica clínica y los programas de salud pública. La globalización de la farmacovigilancia fomenta la colaboración entre las partes interesadas, incluidas las autoridades reguladoras, los proveedores de atención médica y las empresas farmacéuticas. Por ejemplo, la Agencia Europea de Medicamentos (EMA) ha otorgado una importancia cada vez mayor a la colaboración con los reguladores farmacéuticos internacionales para centrarse en áreas como la seguridad de los medicamentos , las inspecciones y el intercambio de información sobre cuestiones de interés mutuo. Este entorno colaborativo mejora el intercambio de datos y mejora la comprensión general de los perfiles de seguridad de los medicamentos. A medida que las empresas buscan aprovechar estas redes globales, la necesidad de soluciones integradas de farmacovigilancia que puedan funcionar en todo el mundo se está volviendo cada vez más esencial.
Los gobiernos de varios países del mundo están llevando a cabo programas de farmacovigilancia en colaboración con los organismos reguladores de sus respectivos países. Los reguladores comprenden la importancia de la farmacovigilancia para garantizar la seguridad de los medicamentos. Por ejemplo, en América del Norte, la FDA de los EE. UU. regula las directrices, leyes y regulaciones para llevar a cabo varias prácticas, como el Programa de Buenas Prácticas Clínicas (BPC) y el Programa de Buenas Prácticas de Farmacovigilancia (BPF), aplicables a los productos biomédicos. Además, en septiembre de 2024, la Comisión de la Farmacopea de la India y la Organización Central de Control de Normas de Medicamentos publicaron la versión 2.0 de sus directrices de farmacovigilancia, promulgando cambios como la ampliación del plazo para informar sobre eventos adversos no graves y la revisión de los requisitos de mantenimiento de registros. Además, la Agencia Nacional de Regulación Farmacéutica de Malasia publicó la segunda edición revisada de sus directrices sobre inspecciones de bioequivalencia y farmacovigilancia. La agencia proporcionó más información sobre el proceso de inspección de medicamentos y el alcance de las evaluaciones relacionadas con las evaluaciones de medicamentos. La Administración de Alimentos y Medicamentos de Filipinas (FDA) también ha publicado acciones detalladas en respuesta a los comentarios sobre el registro de nuevos medicamentos y para proporcionar información sobre los ingredientes farmacéuticos activos (API) para uso humano.
Análisis de segmentación del informe de mercado de software de farmacovigilancia y seguridad de medicamentos
Los segmentos clave que contribuyeron a la derivación del análisis del mercado de software de farmacovigilancia y seguridad de medicamentos son las ofertas, el tamaño de la organización, la implementación, la forma, la funcionalidad y el usuario final.
- Según el tamaño de las organizaciones, el mercado europeo de software de farmacovigilancia y seguridad de medicamentos se divide en grandes empresas y pymes. El segmento de las grandes empresas dominó el mercado en 2023.
- En cuanto a la oferta, el mercado se divide en software y servicios. El segmento de software tuvo una mayor participación en el mercado en 2023.
- Según la implementación, el mercado europeo de software de farmacovigilancia y seguridad de medicamentos se divide en nube y local. El segmento de la nube dominó el mercado en 2023
- Según la forma, el mercado europeo de software de farmacovigilancia y seguridad de medicamentos se divide en estándar y personalizado. El segmento estándar dominó el mercado en 2023.
- Por funcionalidad, el mercado europeo de software de farmacovigilancia y seguridad de medicamentos se segmenta en gestión de casos, gestión de señales y riesgos, calidad y cumplimiento, soporte de auditoría y cumplimiento de la formación, seguimiento de problemas y seguimiento de eventos adversos, gestión de seguridad clínica y seguridad de ensayos clínicos, redacción médica, análisis de atención sanitaria y otros. El segmento de gestión de señales y riesgos tuvo la mayor participación del mercado en 2023.
- Según el usuario final, el mercado europeo de software de farmacovigilancia y seguridad de medicamentos está segmentado en empresas farmacéuticas y biotecnológicas, organizaciones de investigación por contrato, empresas de subcontratación de procesos comerciales y otros proveedores de servicios de farmacovigilancia. El segmento de empresas farmacéuticas y biotecnológicas dominó el mercado en 2023.
Análisis de la cuota de mercado del software de farmacovigilancia y seguridad de medicamentos por geografía
El mercado de software de farmacovigilancia y seguridad de medicamentos está segmentado en cinco regiones principales: América del Norte, Europa, Asia Pacífico (APAC), Oriente Medio y África (MEA) y América del Sur y Central. América del Norte dominó el mercado en 2023, seguida de Europa y APAC.
Norteamérica está experimentando un enorme crecimiento en el mercado de software de farmacovigilancia y seguridad de medicamentos, debido a la presencia de varios actores del mercado como IQVIA Oracle Corporation, que trabajan continuamente en el avance del software de farmacovigilancia y seguridad de medicamentos. En julio de 2024, Oracle Corporation lanzó una plataforma Oracle Argus basada en IA como solución Safety One Intake. Esta solución ayuda a las organizaciones de ciencias biológicas a cumplir con los crecientes requisitos regulatorios, así como a mitigar el creciente volumen de casos de eventos adversos. Esta nueva plataforma de farmacovigilancia tenía como objetivo aumentar la productividad, mejorar la privacidad de los datos y mejorar los informes. Por lo tanto, estas innovaciones de productos por parte de los actores del mercado en la región están impulsando el crecimiento del mercado de software de farmacovigilancia y seguridad de medicamentos.
Alcance del informe de mercado de software de farmacovigilancia y seguridad de medicamentos
| Atributo del informe | Detalles |
|---|---|
| Tamaño del mercado en 2023 | US$ 214,39 millones |
| Tamaño del mercado en 2031 | US$ 359,30 millones |
| CAGR global (2023 - 2031) | 6,7% |
| Datos históricos | 2021-2022 |
| Período de pronóstico | 2024-2031 |
| Segmentos cubiertos | Al ofrecer
|
| Regiones y países cubiertos | América del norte
|
| Líderes del mercado y perfiles de empresas clave |
|
- El PDF de muestra muestra la estructura del contenido y la naturaleza de la información con análisis cualitativo y cuantitativo.
Noticias y desarrollos recientes del mercado de software de farmacovigilancia y seguridad de medicamentos
El mercado de software de farmacovigilancia y seguridad de medicamentos se evalúa mediante la recopilación de datos cualitativos y cuantitativos posteriores a la investigación primaria y secundaria, que incluye publicaciones corporativas importantes, datos de asociaciones y bases de datos. A continuación, se enumeran algunos de los desarrollos clave en el mercado de software de farmacovigilancia y seguridad de medicamentos:
- ArisGlobal, líder del mercado en soluciones tecnológicas para el desarrollo de fármacos a nivel mundial, anunció que Medac, un fabricante farmacéutico con sede en Alemania especializado en los campos de la oncología y la hematología, la urología y las enfermedades autoinmunes, eligió a LifeSphere Safety para modernizar sus procesos de seguridad de los fármacos. El análisis preciso y específico de cada paciente y población es crucial para minimizar los riesgos del tratamiento para los pacientes, lo que favorece el mejor resultado posible del tratamiento. (Fuente: ArisGlobal, comunicado de prensa, mayo de 2023)
- IQVIA, un proveedor líder mundial de análisis avanzados, soluciones tecnológicas y servicios de investigación clínica para la industria de las ciencias biológicas, anunció una colaboración estratégica con Argenx para avanzar en el tratamiento de pacientes con enfermedades autoinmunes raras a través de servicios y soluciones de seguridad de farmacovigilancia (PV) innovadores e integrados basados en tecnología. (Fuente: IQVIA, comunicado de prensa, enero de 2023)
Informe de mercado sobre software de farmacovigilancia y seguridad de medicamentos: cobertura y resultados
El informe "Tamaño y pronóstico del mercado de software de farmacovigilancia y seguridad de medicamentos (2021-2031)" proporciona un análisis detallado del mercado que cubre las áreas mencionadas a continuación:
- Tamaño y pronóstico del mercado de software de farmacovigilancia y seguridad de medicamentos a nivel mundial, regional y nacional para todos los segmentos clave del mercado cubiertos por el alcance
- Tendencias del mercado de software de farmacovigilancia y seguridad de medicamentos, así como dinámicas del mercado, como impulsores, restricciones y oportunidades clave
- Análisis PEST y FODA detallados
- Análisis del mercado de software de farmacovigilancia y seguridad de medicamentos que abarca las tendencias clave del mercado, el marco global y regional, los principales actores, las regulaciones y los desarrollos recientes del mercado
- Análisis del panorama de la industria y de la competencia que abarca la concentración del mercado, el análisis de mapas de calor, los actores destacados y los desarrollos recientes para el mercado de software de farmacovigilancia y seguridad de medicamentos
- Perfiles detallados de empresas
- Análisis histórico (2 años), año base, pronóstico (7 años) con CAGR
- Análisis PEST y FODA
- Tamaño del mercado Valor/volumen: global, regional, nacional
- Industria y panorama competitivo
- Conjunto de datos de Excel
- Collagen Peptides Market
- Embolization Devices Market
- Enteral Nutrition Market
- Analog-to-Digital Converter Market
- Latent TB Detection Market
- Mobile Phone Insurance Market
- Social Employee Recognition System Market
- Aesthetic Medical Devices Market
- Oxy-fuel Combustion Technology Market
- Clear Aligners Market

Report Coverage
Revenue forecast, Company Analysis, Industry landscape, Growth factors, and Trends
Segment Covered
This text is related
to segments covered.

Regional Scope
North America, Europe, Asia Pacific, Middle East & Africa, South & Central America
Country Scope
This text is related
to country scope.
Preguntas frecuentes
Integration of cloud-based platforms that offers real-time access to data from anywhere across the globe, enabling pharmaceutical companies to respond swiftly to emerging safety concerns.
ArisEurope, ICON plc, Syneos Health, Accenture, IQVIA, Genpact, Cognizant, Paraxel International Corporation, Laboratory Corporation of America Holdings, Max Application, Clinevo Technologies, Qinecsa Solutions, AB Cube, and Veeva Systems are among the key players operating in the global pharmacovigilance and drug safety software market.
The pharmacovigilance and drug safety software market was valued at US$ 214.39 billion in 2023 and is anticipated to grow at a CAGR of 6.7% over the forecast period.
The rising cases of adverse drug reactions (ADRs) worldwide owing to the increasing prevalence of chronic diseases drives the market growth.
Asia Pacific is anticipated to grow at the fastest CAGR over the forecast period.
The software segment led the pharmacovigilance and drug safety software market with a significant share in 2023.
The pharmacovigilance and drug safety software market are expected to reach US$ 359.30 million by 2031 and is expected to register a CAGR of 6.7% during 2023–2031.
Trends and growth analysis reports related to Technology, Media and Telecommunications : READ MORE..
The List of Companies - Pharmacovigilance and Drug Safety Software Market
- ArisGlobal LLC
- Max Application
- Oracle Corp
- Veeva Systems Inc
- IQVIA Holdings Inc
- ICON Plc
- Cognizant Technology Solutions Corp
- Accenture Plc
- Syneos Health Inc
- Genpact Ltd.
The Insight Partners performs research in 4 major stages: Data Collection & Secondary Research, Primary Research, Data Analysis and Data Triangulation & Final Review.
- Data Collection and Secondary Research:
As a market research and consulting firm operating from a decade, we have published and advised several client across the globe. First step for any study will start with an assessment of currently available data and insights from existing reports. Further, historical and current market information is collected from Investor Presentations, Annual Reports, SEC Filings, etc., and other information related to company’s performance and market positioning are gathered from Paid Databases (Factiva, Hoovers, and Reuters) and various other publications available in public domain.
Several associations trade associates, technical forums, institutes, societies and organization are accessed to gain technical as well as market related insights through their publications such as research papers, blogs and press releases related to the studies are referred to get cues about the market. Further, white papers, journals, magazines, and other news articles published in last 3 years are scrutinized and analyzed to understand the current market trends.
- Primary Research:
The primarily interview analysis comprise of data obtained from industry participants interview and answers to survey questions gathered by in-house primary team.
For primary research, interviews are conducted with industry experts/CEOs/Marketing Managers/VPs/Subject Matter Experts from both demand and supply side to get a 360-degree view of the market. The primary team conducts several interviews based on the complexity of the markets to understand the various market trends and dynamics which makes research more credible and precise.
A typical research interview fulfils the following functions:
- Provides first-hand information on the market size, market trends, growth trends, competitive landscape, and outlook
- Validates and strengthens in-house secondary research findings
- Develops the analysis team’s expertise and market understanding
Primary research involves email interactions and telephone interviews for each market, category, segment, and sub-segment across geographies. The participants who typically take part in such a process include, but are not limited to:
- Industry participants: VPs, business development managers, market intelligence managers and national sales managers
- Outside experts: Valuation experts, research analysts and key opinion leaders specializing in the electronics and semiconductor industry.
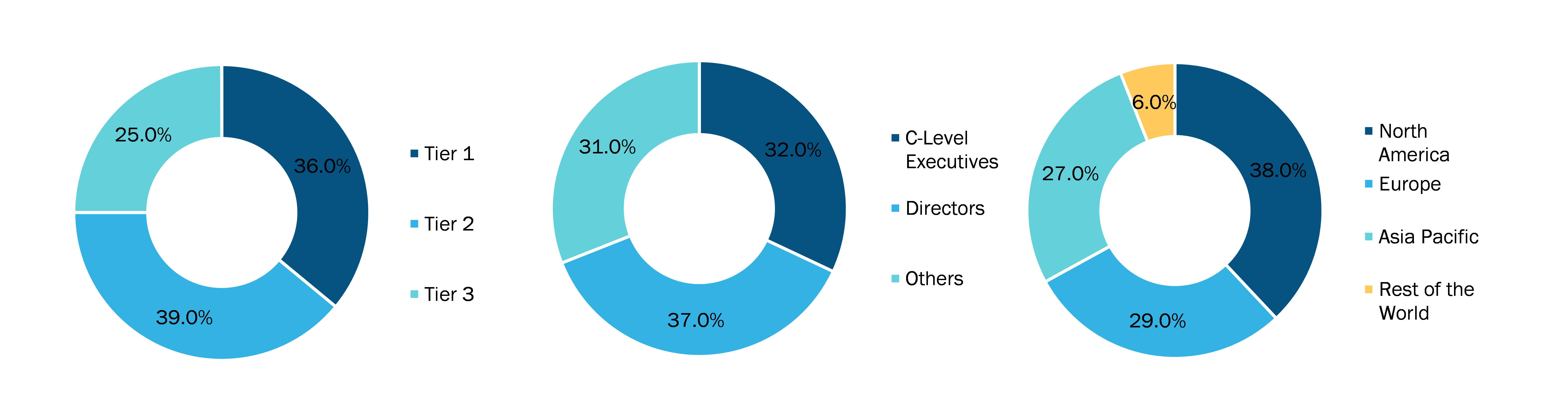
Below is the breakup of our primary respondents by company, designation, and region:
Once we receive the confirmation from primary research sources or primary respondents, we finalize the base year market estimation and forecast the data as per the macroeconomic and microeconomic factors assessed during data collection.
- Data Analysis:
Once data is validated through both secondary as well as primary respondents, we finalize the market estimations by hypothesis formulation and factor analysis at regional and country level.
- Macro-Economic Factor Analysis:
We analyse macroeconomic indicators such the gross domestic product (GDP), increase in the demand for goods and services across industries, technological advancement, regional economic growth, governmental policies, the influence of COVID-19, PEST analysis, and other aspects. This analysis aids in setting benchmarks for various nations/regions and approximating market splits. Additionally, the general trend of the aforementioned components aid in determining the market's development possibilities.
- Country Level Data:
Various factors that are especially aligned to the country are taken into account to determine the market size for a certain area and country, including the presence of vendors, such as headquarters and offices, the country's GDP, demand patterns, and industry growth. To comprehend the market dynamics for the nation, a number of growth variables, inhibitors, application areas, and current market trends are researched. The aforementioned elements aid in determining the country's overall market's growth potential.
- Company Profile:
The “Table of Contents” is formulated by listing and analyzing more than 25 - 30 companies operating in the market ecosystem across geographies. However, we profile only 10 companies as a standard practice in our syndicate reports. These 10 companies comprise leading, emerging, and regional players. Nonetheless, our analysis is not restricted to the 10 listed companies, we also analyze other companies present in the market to develop a holistic view and understand the prevailing trends. The “Company Profiles” section in the report covers key facts, business description, products & services, financial information, SWOT analysis, and key developments. The financial information presented is extracted from the annual reports and official documents of the publicly listed companies. Upon collecting the information for the sections of respective companies, we verify them via various primary sources and then compile the data in respective company profiles. The company level information helps us in deriving the base number as well as in forecasting the market size.
- Developing Base Number:
Aggregation of sales statistics (2020-2022) and macro-economic factor, and other secondary and primary research insights are utilized to arrive at base number and related market shares for 2022. The data gaps are identified in this step and relevant market data is analyzed, collected from paid primary interviews or databases. On finalizing the base year market size, forecasts are developed on the basis of macro-economic, industry and market growth factors and company level analysis.
- Data Triangulation and Final Review:
The market findings and base year market size calculations are validated from supply as well as demand side. Demand side validations are based on macro-economic factor analysis and benchmarks for respective regions and countries. In case of supply side validations, revenues of major companies are estimated (in case not available) based on industry benchmark, approximate number of employees, product portfolio, and primary interviews revenues are gathered. Further revenue from target product/service segment is assessed to avoid overshooting of market statistics. In case of heavy deviations between supply and demand side values, all thes steps are repeated to achieve synchronization.
We follow an iterative model, wherein we share our research findings with Subject Matter Experts (SME’s) and Key Opinion Leaders (KOLs) until consensus view of the market is not formulated – this model negates any drastic deviation in the opinions of experts. Only validated and universally acceptable research findings are quoted in our reports.
We have important check points that we use to validate our research findings – which we call – data triangulation, where we validate the information, we generate from secondary sources with primary interviews and then we re-validate with our internal data bases and Subject matter experts. This comprehensive model enables us to deliver high quality, reliable data in shortest possible time.
 Obtenga una muestra gratuita de este informe
Obtenga una muestra gratuita de este informe