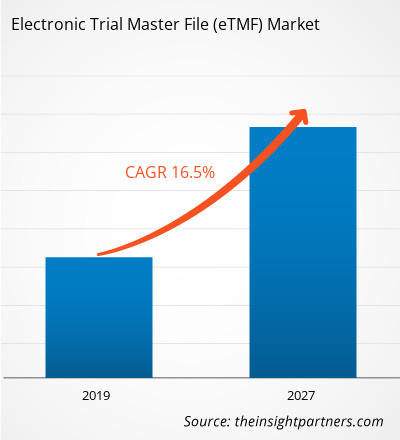
[Rapport de recherche] Le marché du dossier électronique principal des essais cliniques (Electronic Trial Master File) dans le secteur de la santé était évalué à 938,32 millions USD en 2018 et devrait atteindre 3 155,64 millions USD d'ici 2027 ; il devrait croître à un TCAC de 16,5 % de 2019 à 2027.
Les systèmes de fichiers maîtres d'essais électroniques (eTMF) peuvent être définis comme une intégration de composants logiciels et matériels collectivement responsables de la gestion optimale des données d'essais cliniques. Ces solutions aident à rationaliser les données générées au cours d'un essai clinique dans un format numérique facile à stocker, qui peut être récupéré par des utilisateurs différents, ce qui est bénéfique en termes d'accessibilité facile et de réduction des coûts associés aux opérations administratives et de maintenance manuelle des données dans les essais cliniques. La croissance du fichier maître d'essais électroniques sur le marché des soins de santé est attribuée à l'augmentation du nombre d'essais cliniques, à la prévalence croissante des maladies et aux progrès technologiques qui ont stimulé le marché au fil des ans. Cependant, la pénurie de professionnels qualifiés est susceptible d'avoir un impact négatif sur la croissance du marché dans les années à venir. D'autre part, l'augmentation des initiatives stratégiques des acteurs du marché est susceptible d'offrir des opportunités de croissance au cours des prochaines années.
Le marché des dossiers électroniques d'essais cliniques dans le secteur de la santé devrait connaître une croissance substantielle après la pandémie. Le COVID-19 a affecté les économies et les industries de divers pays en raison des confinements, des interdictions de voyager et des fermetures d'entreprises. La crise du COVID-19 a surchargé les systèmes de santé publique de nombreux pays et a mis en évidence le fort besoin d'investissements durables dans les systèmes de santé. À mesure que la pandémie de COVID-19 progresse, le secteur de la santé devrait connaître une baisse de croissance. Le secteur des sciences de la vie prospère en raison de la demande accrue de produits de diagnostic in vitro et de l'augmentation des activités de recherche et développement dans le monde entier. Cependant, le secteur des technologies médicales et de l'imagerie connaît une baisse des ventes en raison d'un nombre réduit d'interventions chirurgicales effectuées et d'un approvisionnement en équipement retardé ou prolongé. En outre, les consultations virtuelles par les professionnels de la santé devraient devenir le modèle de prestation de soins courant après la pandémie. La télésanté transformant la prestation de soins, la santé numérique continuera de prospérer dans les années à venir. En outre, les essais cliniques perturbés et le retard subséquent dans les lancements de médicaments devraient également ouvrir la voie à des essais entièrement virtuels à l'avenir. De nouvelles technologies telles que l’ARNm devraient émerger et bouleverser l’industrie pharmaceutique et le marché devrait également connaître davantage d’intégration verticale et de coentreprises dans les années à venir.
Personnalisez ce rapport en fonction de vos besoins
Vous bénéficierez d'une personnalisation gratuite de n'importe quel rapport, y compris de certaines parties de ce rapport, d'une analyse au niveau des pays, d'un pack de données Excel, ainsi que de superbes offres et réductions pour les start-ups et les universités.
- Obtenez les principales tendances clés du marché de ce rapport.Cet échantillon GRATUIT comprendra une analyse de données, allant des tendances du marché aux estimations et prévisions.
Informations sur le marché
Les applications croissantes du dossier électronique principal des essais dans le secteur de la santé devraient stimuler la croissance du marché du dossier électronique principal des essais dans le secteur de la santé
La recherche et le développement (R&D) constituent une part importante et essentielle de l'activité d'une entreprise. Les activités de l'industrie pharmaceutique ont des impacts socio-économiques importants sur la société sous la forme d'investissements en R&D et en fabrication. La recherche et le développement constituent la « colonne vertébrale » de tout système de découverte de médicaments vers le succès, et le fichier maître d'essai électronique est un logiciel essentiel dans la recherche et le développement de nouvelles entités thérapeutiques pharmaceutiques et biotechnologiques. Les sociétés pharmaceutiques et biotechnologiques se concentrent principalement sur la recherche et le développement (R&D) pour proposer de nouvelles molécules pour diverses applications thérapeutiques avec le potentiel médical et commercial le plus important. Les entreprises investissent majoritairement dans la R&D dans le but de fournir des produits de haute qualité et innovants sur le marché. Par exemple, les dépenses mondiales en R&D en 2017 ont augmenté de 3,9 % pour atteindre 165 milliards de dollars par rapport à 2016. Les dépenses moyennes en R&D ont augmenté modérément pour atteindre 20,9 % en pourcentage des ventes totales de médicaments sur ordonnance. En outre, selon une enquête annuelle menée auprès des membres de la PhRMA en 2017, les sociétés pharmaceutiques ont déclaré avoir dépensé 71,4 milliards de dollars en recherche et développement.
Les sociétés pharmaceutiques ont investi davantage dans la R&D pour accélérer leur processus d'essais cliniques. Par exemple, au 30 juin 2019, AstraZeneca a ouvert la voie en consacrant 25,63 % de son chiffre d'affaires à la recherche et au développement ; au 31 mars 2019, Holding Strong, Eli Lilly and Company a consacré 22,38 % de son chiffre d'affaires à la R&D ; et au 30 juin 2019, Roche Holding AG n'était pas loin derrière avec 21,29 % consacrés à la R&D.
Les dépenses de recherche et développement sont généralement engagées lors des processus de découverte, de test et de développement de nouveaux produits, des paiements initiaux et des étapes clés, de l'amélioration des résultats existants, ainsi que de la démonstration de l'efficacité du produit et de la conformité réglementaire avant son lancement. De plus, les investissements en R&D des sociétés pharmaceutiques aux États-Unis ont augmenté de manière constante au cours des 15 dernières années.
Le développement et la découverte de médicaments sont des processus longs et coûteux. Le processus, de la détection précoce ou de la conception au développement jusqu'à l'approbation réglementaire, peut prendre plus de 10 à 15 ans. Tout au long de la phase de développement d'une substance médicamenteuse, divers services de test sont nécessaires pour vérifier la qualité et l'efficacité du produit. Par conséquent, les sociétés pharmaceutiques et biotechnologiques préfèrent enregistrer les données dans un fichier maître électronique pour économiser du temps et de l'argent, ce qui devrait stimuler la croissance du marché.
Les essais cliniques sont l'une des étapes les plus importantes et les plus significatives de la découverte de médicaments, que le traitement, la stratégie médicale ou le dispositif soient sûrs et efficaces pour l'usage humain ou vétérinaire. Les études cliniques aident à comprendre et à déterminer les meilleures approches de traitement pour certains domaines thérapeutiques. Les essais cliniques sont réalisés spécifiquement pour recueillir des données sur la sécurité et l'efficacité du développement d'un nouveau produit et d'un nouvel outil. Avant que les autorités réglementaires n'approuvent les molécules médicamenteuses et les dispositifs médicaux, une série d'études cliniques est réalisée. La prévalence croissante de diverses maladies transmissibles et non transmissibles augmente la demande de développement de nouveaux médicaments ou dispositifs médicaux pour le traitement. Cela devrait à son tour augmenter la demande d'activités d'essais cliniques pour divers domaines thérapeutiques.
Les sociétés biopharmaceutiques et pharmaceutiques impliquées dans les essais cliniques souhaitent passer d'un système de gestion des documents papier dans des classeurs à un système de gestion des documents électroniques où les documents sont stockés dans des archives électroniques en ligne. En mettant en œuvre un système eTMF complet qui permet aux organisations d'automatiser, de capturer et de gérer les documents et les enregistrements TMF, elles évitent les risques inutiles et peuvent souvent réaliser des économies sur les coûts des essais cliniques par rapport aux processus manuels de traitement du papier.
L'adoption croissante d'un système de fichiers maîtres d'essais électroniques dans le processus clinique est susceptible de stimuler le marché. Par exemple, NextDocs d'Aurea Software est un forum de fichiers maîtres d'essais électroniques (eTMF) pour la coopération clinique dans la gestion des dossiers d'essais cliniques. Il s'agit d'un système de gestion de contenu pour l'industrie pharmaceutique qui offre un moyen formalisé d'organiser et de stocker des documents, des photographies et d'autres contenus numériques pour les essais pharmaceutiques cliniques qui peuvent être requis pour se conformer aux organismes de réglementation gouvernementaux. Dans les essais cliniques, l'EMA soutient pleinement l'utilisation de systèmes eTMF pour le stockage électronique en remplacement du papier. L'agence cite des problèmes de qualité avec les TMF et les eTMF dans une mise en garde en raison du contenu papier et des incohérences telles que des pages manquantes, un étiquetage inapproprié ou des documents incomplets. En raison des fonctionnalités innovantes de l'eTMF telles que la centralisation et la gestion de la documentation des essais cliniques, des capacités de recherche puissantes (avec métadonnées) et de multiples méthodes d'ajout de documents, l'eTMF devient important pour l'efficacité commerciale, les économies de coûts et les délais raccourcis pour la production de produits BioPharma pour mettre en œuvre des processus de gestion électronique des documents. Le secret de l’introduction de cadres eTMF interopérables réside dans l’utilisation d’un modèle de contenu commun, de normes basées sur le vocabulaire et de technologies de normes basées sur le Web.
En raison de l'évolution du fichier maître d'essai vers le fichier maître d'essai électronique, les organismes de recherche sous contrat et les sociétés pharmaceutiques et biotechnologiques adoptent l'eTMF pour une meilleure gestion des données cliniques et un meilleur processus de gestion des essais cliniques. Les raisons et facteurs mentionnés ci-dessus contribuent à stimuler la croissance du marché du fichier maître d'essai électronique.
Informations basées sur les composants
En termes de composants, le marché des dossiers électroniques d'essais cliniques dans le secteur de la santé est segmenté en services et en logiciels. Le segment des services détenait la plus grande part du marché en 2019.
Informations basées sur le mode de livraison
En fonction du mode de livraison, le marché des dossiers électroniques maîtres d'essais sur le marché des soins de santé est segmenté en ETMF basé sur le cloud et ETMF sur site. Le segment eTMF basé sur le cloud détenait la plus grande part de marché en 2019.
Informations basées sur l'utilisateur final
En termes d'utilisateur final, le marché des dossiers électroniques d'essais cliniques dans le domaine de la santé est segmenté en sociétés pharmaceutiques et biotechnologiques, sociétés de recherche et développement et autres. Le segment des sociétés pharmaceutiques et biotechnologiques détenait la plus grande part de marché en 2019.
Les acteurs du marché des dossiers électroniques d'essais sur les soins de santé adoptent des stratégies de lancement et d'expansion de produits pour répondre aux demandes changeantes des clients dans le monde entier, ce qui leur permet également de maintenir leur nom de marque à l'échelle mondiale.
Informations régionales sur le marché du fichier maître d'essai électronique (eTMF)
Les tendances et facteurs régionaux influençant le marché du fichier maître d’essai électronique (eTMF) tout au long de la période de prévision ont été expliqués en détail par les analystes d’Insight Partners. Cette section traite également des segments et de la géographie du marché du fichier maître d’essai électronique (eTMF) en Amérique du Nord, en Europe, en Asie-Pacifique, au Moyen-Orient et en Afrique, ainsi qu’en Amérique du Sud et en Amérique centrale.
- Obtenez les données régionales spécifiques au marché du fichier maître d'essai électronique (eTMF)
Portée du rapport sur le marché du fichier maître d'essai électronique (eTMF)
| Attribut de rapport | Détails |
|---|---|
| Taille du marché en 2018 | 938,32 millions de dollars américains |
| Taille du marché d'ici 2027 | 3 155,64 millions de dollars américains |
| Taux de croissance annuel composé mondial (2018 - 2027) | 16,5% |
| Données historiques | 2016-2017 |
| Période de prévision | 2019-2027 |
| Segments couverts | Par composant
|
| Régions et pays couverts | Amérique du Nord
|
| Leaders du marché et profils d'entreprises clés |
|
Densité des acteurs du marché du fichier maître des procès électroniques (eTMF) : comprendre son impact sur la dynamique des entreprises
Le marché des fichiers maîtres d'essais électroniques (eTMF) connaît une croissance rapide, tirée par la demande croissante des utilisateurs finaux en raison de facteurs tels que l'évolution des préférences des consommateurs, les avancées technologiques et une plus grande sensibilisation aux avantages du produit. À mesure que la demande augmente, les entreprises élargissent leurs offres, innovent pour répondre aux besoins des consommateurs et capitalisent sur les tendances émergentes, ce qui alimente davantage la croissance du marché.
La densité des acteurs du marché fait référence à la répartition des entreprises ou des sociétés opérant sur un marché ou un secteur particulier. Elle indique le nombre de concurrents (acteurs du marché) présents sur un marché donné par rapport à sa taille ou à sa valeur marchande totale.
Les principales entreprises opérant sur le marché du fichier maître d'essai électronique (eTMF) sont :
- Aurea, Inc.
- TRANSPARENT
- Covance Inc (Société de laboratoire)
- Oracle
- Ennov
Avis de non-responsabilité : les sociétés répertoriées ci-dessus ne sont pas classées dans un ordre particulier.
- Obtenez un aperçu des principaux acteurs du marché du fichier maître des procès électroniques (eTMF)
Dossier électronique principal des essais cliniques sur le marché de la santé – par composant
- Service
- Logiciel
Dossier électronique principal des essais cliniques sur le marché des soins de santé – par mode de distribution
- eTMF basé sur le cloud
- eTMF sur site
Dossier électronique principal des essais cliniques sur le marché de la santé – par utilisateur final
- Sociétés pharmaceutiques et biotechnologiques
- Responsables du développement économique
- Autres
Dossier électronique principal des essais cliniques sur le marché des soins de santé – par géographie
Amérique du Nord
- NOUS
- Canada
- Mexique
Europe
- France
- Allemagne
- Italie
- ROYAUME-UNI
- Espagne
- Reste de l'Europe
Asie-Pacifique (APAC)
- Chine
- Inde
- Corée du Sud
- Japon
- Australie
- Reste de l'APAC
Moyen-Orient et Afrique (MEA)
- Afrique du Sud
- Arabie Saoudite
- Émirats arabes unis
- Reste de la MEA
Amérique du Sud et Amérique centrale (SCAM)
- Brésil
- Argentine
- Reste de SCAM
Profils d'entreprise
- Aurea, Inc.
- Transparfait.
- Covance Inc (Société de laboratoire)
- Oracle
- Ennov
- Mastercontrol, Inc.
- Omnicom
- Pharmavigilance
- Systèmes Veeva
- Phlexglobal
- Analyse historique (2 ans), année de base, prévision (7 ans) avec TCAC
- Analyse PEST et SWO
- Taille du marché Valeur / Volume - Mondial, Régional, Pays
- Industrie et paysage concurrentiel
- Ensemble de données Excel

Report Coverage
Revenue forecast, Company Analysis, Industry landscape, Growth factors, and Trends
Segment Covered
This text is related
to segments covered.

Regional Scope
North America, Europe, Asia Pacific, Middle East & Africa, South & Central America
Country Scope
This text is related
to country scope.
Questions fréquemment posées
Pharmaceutical and biotechnology companies, contract research organizations (CROs) and other users can make use of electronic trial master file (eTMF).
Increasing in number of clinical trial, increasing prevalence of diseases and technology advancement have been boosting the market over the years. However, dearth of skilled professionals is likely to have a negative impact on the growth of the market in the coming years. On the other hand, increasing strategic initiatives by market players is likely to provide growth opportunities over the coming years.
Electronic trial master file (eTMF) systems can be defined as an integration of software and hardware components collectively responsible for the optimal management of clinical trial data. These solutions help to streamline the data generated during the course of a clinical trial in an easy-to-store digital format, which can be retrieved by dissimilar users beneficial in easy accessibility and reduction the cost associated with the administrative and manual data maintenance operations in clinical trials.
Trends and growth analysis reports related to Technology, Media and Telecommunications : READ MORE..
The List of Companies - Electronic Trial Master File (eTMF) Market
- Aurea, Inc.
- TRANSPERFECT
- Covance Inc (Lab Corp)
- Oracle
- Ennov
- Mastercontrol, Inc.
- Omnicomm
- Pharmavigilalnce
- Veeva Systems
- Phlexglobal
The Insight Partners performs research in 4 major stages: Data Collection & Secondary Research, Primary Research, Data Analysis and Data Triangulation & Final Review.
- Data Collection and Secondary Research:
As a market research and consulting firm operating from a decade, we have published and advised several client across the globe. First step for any study will start with an assessment of currently available data and insights from existing reports. Further, historical and current market information is collected from Investor Presentations, Annual Reports, SEC Filings, etc., and other information related to company’s performance and market positioning are gathered from Paid Databases (Factiva, Hoovers, and Reuters) and various other publications available in public domain.
Several associations trade associates, technical forums, institutes, societies and organization are accessed to gain technical as well as market related insights through their publications such as research papers, blogs and press releases related to the studies are referred to get cues about the market. Further, white papers, journals, magazines, and other news articles published in last 3 years are scrutinized and analyzed to understand the current market trends.
- Primary Research:
The primarily interview analysis comprise of data obtained from industry participants interview and answers to survey questions gathered by in-house primary team.
For primary research, interviews are conducted with industry experts/CEOs/Marketing Managers/VPs/Subject Matter Experts from both demand and supply side to get a 360-degree view of the market. The primary team conducts several interviews based on the complexity of the markets to understand the various market trends and dynamics which makes research more credible and precise.
A typical research interview fulfils the following functions:
- Provides first-hand information on the market size, market trends, growth trends, competitive landscape, and outlook
- Validates and strengthens in-house secondary research findings
- Develops the analysis team’s expertise and market understanding
Primary research involves email interactions and telephone interviews for each market, category, segment, and sub-segment across geographies. The participants who typically take part in such a process include, but are not limited to:
- Industry participants: VPs, business development managers, market intelligence managers and national sales managers
- Outside experts: Valuation experts, research analysts and key opinion leaders specializing in the electronics and semiconductor industry.
Below is the breakup of our primary respondents by company, designation, and region:
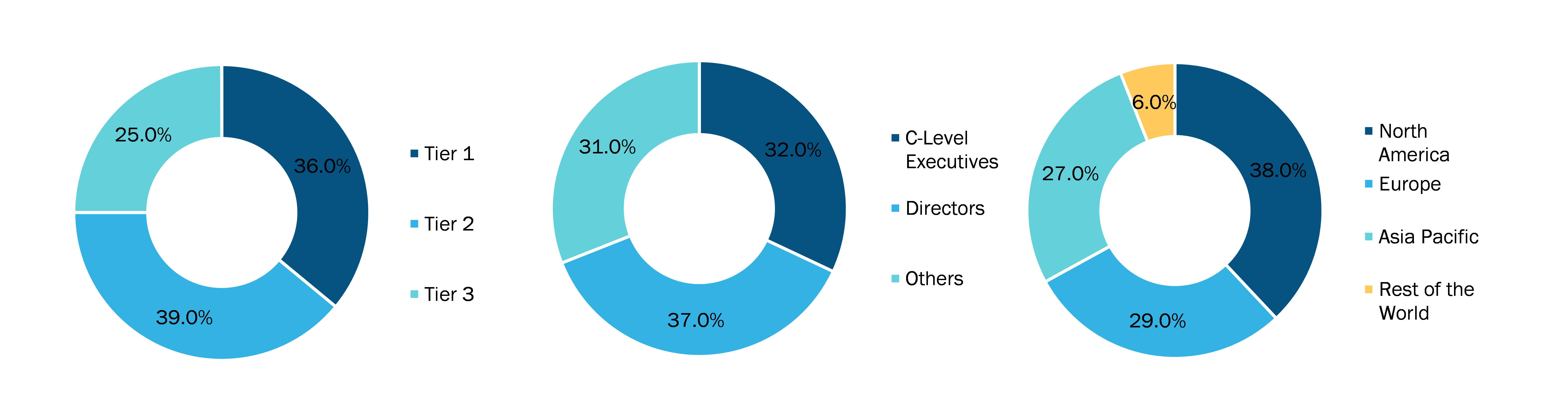
Once we receive the confirmation from primary research sources or primary respondents, we finalize the base year market estimation and forecast the data as per the macroeconomic and microeconomic factors assessed during data collection.
- Data Analysis:
Once data is validated through both secondary as well as primary respondents, we finalize the market estimations by hypothesis formulation and factor analysis at regional and country level.
- Macro-Economic Factor Analysis:
We analyse macroeconomic indicators such the gross domestic product (GDP), increase in the demand for goods and services across industries, technological advancement, regional economic growth, governmental policies, the influence of COVID-19, PEST analysis, and other aspects. This analysis aids in setting benchmarks for various nations/regions and approximating market splits. Additionally, the general trend of the aforementioned components aid in determining the market's development possibilities.
- Country Level Data:
Various factors that are especially aligned to the country are taken into account to determine the market size for a certain area and country, including the presence of vendors, such as headquarters and offices, the country's GDP, demand patterns, and industry growth. To comprehend the market dynamics for the nation, a number of growth variables, inhibitors, application areas, and current market trends are researched. The aforementioned elements aid in determining the country's overall market's growth potential.
- Company Profile:
The “Table of Contents” is formulated by listing and analyzing more than 25 - 30 companies operating in the market ecosystem across geographies. However, we profile only 10 companies as a standard practice in our syndicate reports. These 10 companies comprise leading, emerging, and regional players. Nonetheless, our analysis is not restricted to the 10 listed companies, we also analyze other companies present in the market to develop a holistic view and understand the prevailing trends. The “Company Profiles” section in the report covers key facts, business description, products & services, financial information, SWOT analysis, and key developments. The financial information presented is extracted from the annual reports and official documents of the publicly listed companies. Upon collecting the information for the sections of respective companies, we verify them via various primary sources and then compile the data in respective company profiles. The company level information helps us in deriving the base number as well as in forecasting the market size.
- Developing Base Number:
Aggregation of sales statistics (2020-2022) and macro-economic factor, and other secondary and primary research insights are utilized to arrive at base number and related market shares for 2022. The data gaps are identified in this step and relevant market data is analyzed, collected from paid primary interviews or databases. On finalizing the base year market size, forecasts are developed on the basis of macro-economic, industry and market growth factors and company level analysis.
- Data Triangulation and Final Review:
The market findings and base year market size calculations are validated from supply as well as demand side. Demand side validations are based on macro-economic factor analysis and benchmarks for respective regions and countries. In case of supply side validations, revenues of major companies are estimated (in case not available) based on industry benchmark, approximate number of employees, product portfolio, and primary interviews revenues are gathered. Further revenue from target product/service segment is assessed to avoid overshooting of market statistics. In case of heavy deviations between supply and demand side values, all thes steps are repeated to achieve synchronization.
We follow an iterative model, wherein we share our research findings with Subject Matter Experts (SME’s) and Key Opinion Leaders (KOLs) until consensus view of the market is not formulated – this model negates any drastic deviation in the opinions of experts. Only validated and universally acceptable research findings are quoted in our reports.
We have important check points that we use to validate our research findings – which we call – data triangulation, where we validate the information, we generate from secondary sources with primary interviews and then we re-validate with our internal data bases and Subject matter experts. This comprehensive model enables us to deliver high quality, reliable data in shortest possible time.

 Obtenez un échantillon gratuit pour ce rapport
Obtenez un échantillon gratuit pour ce rapport