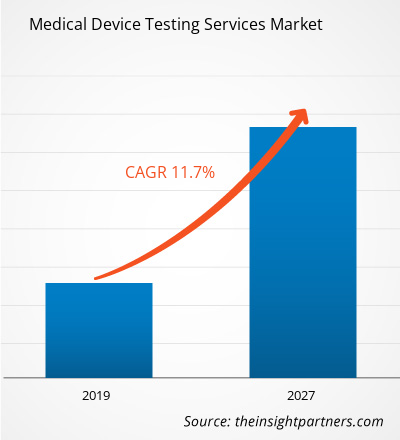
Le marché des services de test de dispositifs médicaux sur les soins de santé était évalué à 5 505,4 millions USD en 2018 et devrait atteindre 14 660,1 millions USD d'ici 2027 ; il devrait croître à un TCAC de 11,7 % de 2019 à 2027.
Les dispositifs médicaux sont très importants car ils ont un impact direct sur la vie du patient. Pour offrir aux patients des expériences de haute qualité et sûres, les fabricants de dispositifs médicaux testent les dispositifs médicaux avant de les mettre sur le marché. Les fabricants de dispositifs médicaux préfèrent effectuer des tests en interne ou sous-traiter les services de test aux organismes de recherche sous contrat (CRO) pour se conformer aux directives réglementaires strictes. Les tests des dispositifs médicaux visent à garantir la sécurité, la qualité et la cohérence du service à toutes les étapes du développement et de l'utilisation du dispositif médical. Le traitement médical dépend fortement des dispositifs médicaux, il est donc important de s'assurer que les tests des dispositifs médicaux sont effectués avec la plus grande compétence. La croissance des services de test des dispositifs médicaux sur le marché des soins de santé est attribuée au développement de produits innovants, aux collaborations, aux fusions et acquisitions, au scénario réglementaire strict pour l'approbation des dispositifs médicaux qui stimulent la croissance du marché au fil des ans. En outre, les développements dans l'industrie des dispositifs médicaux sont susceptibles d'avoir un impact positif sur la demande du marché au cours de la période de prévision. Cependant, la croissance du marché est freinée par des facteurs tels que les interruptions des obligations contractuelles.
Le marché des services de test de dispositifs médicaux sur les soins de santé devrait connaître une croissance substantielle après la pandémie. SGS SA, Eurofins, Toxikon, Pace Analytical Services, LLC, Intertek Group plc, NORTH AMERICAN SCIENCE ASSOCIATES INC., Charles River, WuXi AppTec, Element Materials Technology, TÜV SÜD AG L'ARNm devrait émerger et faire évoluer l'industrie pharmaceutique et le marché devrait également connaître davantage d'intégration verticale et de coentreprises dans les années à venir.
Informations sur le marché
Les applications croissantes des services de test de dispositifs médicaux dans le secteur de la santé devraient stimuler la croissance du marché des services de test de dispositifs médicaux dans le secteur de la santé
Personnalisez ce rapport en fonction de vos besoins
Vous bénéficierez d'une personnalisation gratuite de n'importe quel rapport, y compris de certaines parties de ce rapport, d'une analyse au niveau des pays, d'un pack de données Excel, ainsi que de superbes offres et réductions pour les start-ups et les universités.
- Obtenez les principales tendances clés du marché de ce rapport.Cet échantillon GRATUIT comprendra une analyse de données, allant des tendances du marché aux estimations et prévisions.
Les tests de dispositifs médicaux nécessitent une solide expérience du domaine, des législations nationales et locales, ainsi que des informations sur les dispositifs, l'infrastructure et la capacité à prendre en charge les tests. Le secteur de la santé et des dispositifs médicaux est très actif en raison du développement continu et des solutions avancées. Les améliorations apportées à la technologie des dispositifs médicaux ont considérablement amélioré l'efficacité des soins aux patients au cours des dernières décennies.
Toutefois, les fabricants de divers dispositifs médicaux sont parfois confrontés à des difficultés pour préparer leurs produits à la commercialisation. Les réglementations sont parfois complexes et difficiles à comprendre, notamment lorsqu'elles concernent des applications de dispositifs médicaux innovants et novateurs.
Un rappel est un processus d'élimination ou de modification de produits qui ne sont pas conformes aux lois administrées par la Food and Drug Administration (FDA). La plupart des rappels de dispositifs médicaux sont effectués volontairement par l'entreprise en vertu du 21 CFR 7. Les rappels de produits sont classés en différentes désignations, telles que I, II ou III par la FDA pour indiquer le degré comparatif de danger pour la santé présenté par le produit rappelé.
Selon la FDA, en 2018, plus de 80 000 incidents liés à des blessures causées par des dispositifs médicaux ont été identifiés depuis 2008. Depuis quelques années, les fabricants de dispositifs médicaux et les médecins ont constaté que les stimulateurs de la moelle épinière ont aidé les patients souffrant de troubles de la douleur. De ce fait, ils sont devenus l'un des produits les plus en vogue dans l'industrie des dispositifs médicaux, qui représente 400 milliards de dollars. Par conséquent, l'augmentation des rappels de produits et la demande accrue de produits de qualité augmentent le besoin de tester les dispositifs médicaux. Par conséquent, cela stimulera le marché des services de test des dispositifs médicaux.
Français La technologie des dispositifs médicaux améliore la vie en identifiant les maladies à un stade précoce et en améliorant le traitement, le diagnostic et la surveillance des patients. Les programmes de formation des petites et moyennes entreprises (PME) ont été mis en œuvre dans des pays comme la Chine, le Chili, l'Indonésie, le Mexique, la Malaisie, Singapour, les Philippines, le Pérou, la Russie et le Vietnam, entre autres. En 2018, le marché des dispositifs médicaux au Royaume-Uni était évalué à environ 10,6 milliards de dollars américains. Parmi elles, environ 2 500 sont des petites et moyennes entreprises de dispositifs médicaux au Royaume-Uni. De plus, un grand nombre de multinationales ont établi leur siège social ou leurs filiales dans le pays. En outre, chaque année, les fiducies aiguës dépensent en moyenne environ 6,6 milliards de dollars américains en fournitures cliniques, qui comprennent des équipements médicaux.
En outre, en 2018, l'Administration du commerce international (ITA) a mentionné qu'il y avait plus de 1 300 entreprises de dispositifs médicaux en France, dont un tiers sont des entreprises étrangères. Cependant, ces entreprises étrangères de dispositifs médicaux représentent environ deux tiers du chiffre d'affaires total.
De plus, parmi les 1 300 entreprises de dispositifs médicaux en France, environ 92 % sont des petites et moyennes entreprises (PME), dont 88 % produisent entièrement des dispositifs médicaux. Les PME sous-traitent les tests des dispositifs médicaux car ils nécessitent des coûts élevés, du temps et une main-d'œuvre qualifiée.
De plus, Madrid et la Catalogne représentent plus de 80 % des ventes de dispositifs médicaux. Parmi celles-ci, 90 % du marché des dispositifs médicaux sont des petites et moyennes entreprises qui génèrent environ 40 % du chiffre d'affaires total des dispositifs médicaux. Étant donné que ces entreprises sont des start-ups, elles choisissent d'externaliser les tests des dispositifs médicaux pour réduire les coûts et gagner du temps. Ainsi, le besoin croissant de l'industrie devrait stimuler la croissance du marché mondial des services de test des dispositifs médicaux au cours des prochaines années. Mettre à la disposition des consommateurs une technologie de pointe en matière de dispositifs médicaux est une priorité absolue.
- Cet échantillon GRATUIT comprendra une analyse de données, allant des tendances du marché aux estimations et prévisions.
projet de risque. Par conséquent, les entreprises proposent des tests corrects en fournissant des résultats précis et fiables pour les besoins de test des dispositifs médicaux, des petites entreprises en démarrage aux grands fabricants établis.
De nombreux laboratoires en Amérique du Nord, en Europe et en Asie-Pacifique offrent des connaissances en matière de conformité réglementaire et des tests GMP/GLP/ISO 17025 qualifiés pour garantir des délais d'amélioration rapides en utilisant le plus haut niveau de service et les technologies les plus avancées pour les exigences de tests microbiologiques, chimiques analytiques, de biocompatibilité et d'emballage.
Dans d'autres pays, différents organismes de réglementation sont présents pour réglementer les dispositifs médicaux. En Espagne, les dispositifs médicaux sont contrôlés et autorisés par l'Agence espagnole des médicaments et des produits de santé (AEMPS). La loi sur les aliments et les drogues (FDA) établit un cadre réglementaire pour de nombreux dispositifs médicaux. Le Bureau des dispositifs médicaux est un autre organisme responsable des directives sur les dispositifs médicaux qui autorisent la vente et l'importation de dispositifs médicaux.
Tous les dispositifs médicaux sont soumis à un ensemble exclusif et systématique de tests imposés par la FDA, la China Food and Drug Administration (CFDA), les organismes notifiés de l'UE et d'autres organismes de réglementation, qui doivent être suivis avant d'entrer sur le marché.
Au Canada, Santé Canada a mis en place une déclaration obligatoire des incidents liés aux dispositifs médicaux par les importateurs et les fabricants et encourage également les professionnels de la santé, les hôpitaux et les consommateurs/patients à signaler ces incidents. Au Mexique, COFEPRIS est responsable de l'approbation et de l'enregistrement des dispositifs médicaux. Le fabricant doit satisfaire à toutes les exigences de test et se conformer à la demande d'approbation de COFEPRIS.
L'Agence de réglementation des médicaments et des produits de santé (MHRA) est l'autorité compétente chargée d'appliquer la loi sur les dispositifs médicaux au Royaume-Uni. Elle inspecte les dispositifs médicaux présentant des problèmes potentiels et garantit leur sécurité et leur qualité. Au Japon, c'est le ministère japonais de la Santé, du Travail et de la Protection sociale (MHLW) et l'Agence des produits pharmaceutiques et des dispositifs médicaux (PMDA) qui travaillent ensemble pour effectuer des tests scientifiques sur les dispositifs médicaux destinés à la commercialisation afin de surveiller leur sécurité après la commercialisation.
Ainsi, les réglementations de plus en plus strictes concernant les dispositifs innovants et précis devraient stimuler la croissance du marché des services de test de dispositifs médicaux au cours de la période de prévision.
Informations basées sur les services
En termes de service, les services de test des dispositifs médicaux sur le marché des soins de santé sont segmentés en tests de biocompatibilité, tests de chimie, tests de microbiologie et de stérilité et validation des emballages. En 2018, les tests de microbiologie et de stérilité détenaient la part de marché la plus importante, soit 53,55 % du marché des services de test des dispositifs médicaux, par service.
Aperçu régional du marché des services de test de dispositifs médicaux
Les tendances et facteurs régionaux influençant le marché des services de test de dispositifs médicaux tout au long de la période de prévision ont été expliqués en détail par les analystes d’Insight Partners. Cette section traite également des segments et de la géographie du marché des services de test de dispositifs médicaux en Amérique du Nord, en Europe, en Asie-Pacifique, au Moyen-Orient et en Afrique, ainsi qu’en Amérique du Sud et en Amérique centrale.
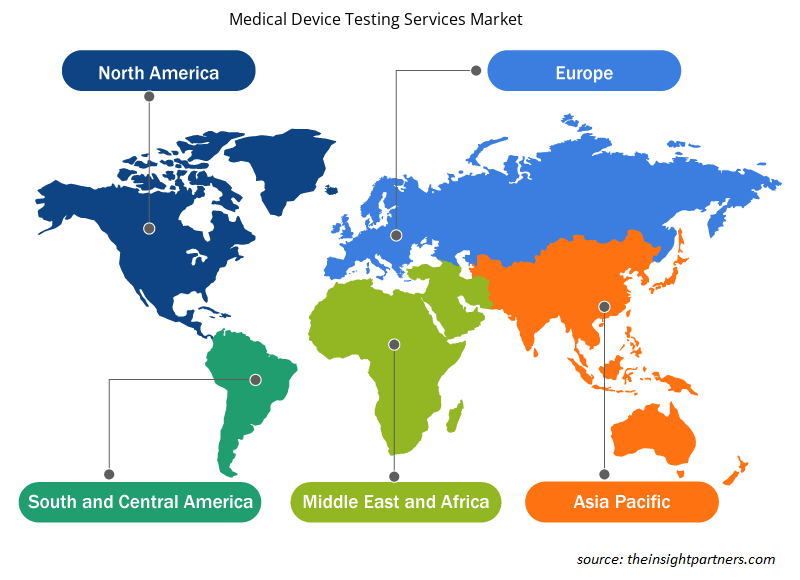
- Obtenez les données régionales spécifiques au marché des services de test de dispositifs médicaux
Portée du rapport sur le marché des services de test de dispositifs médicaux
| Attribut de rapport | Détails |
|---|---|
| Taille du marché en 2018 | 5,51 milliards de dollars américains |
| Taille du marché d'ici 2027 | 14,66 milliards de dollars américains |
| Taux de croissance annuel composé mondial (2018 - 2027) | 11,7% |
| Données historiques | 2016-2017 |
| Période de prévision | 2019-2027 |
| Segments couverts | Par service
|
| Régions et pays couverts | Amérique du Nord
|
| Leaders du marché et profils d'entreprises clés |
|
Densité des acteurs du marché des services de test de dispositifs médicaux : comprendre son impact sur la dynamique commerciale
Le marché des services de test de dispositifs médicaux connaît une croissance rapide, tirée par la demande croissante des utilisateurs finaux en raison de facteurs tels que l'évolution des préférences des consommateurs, les avancées technologiques et une plus grande sensibilisation aux avantages du produit. À mesure que la demande augmente, les entreprises élargissent leurs offres, innovent pour répondre aux besoins des consommateurs et capitalisent sur les tendances émergentes, ce qui alimente davantage la croissance du marché.
La densité des acteurs du marché fait référence à la répartition des entreprises ou des sociétés opérant sur un marché ou un secteur particulier. Elle indique le nombre de concurrents (acteurs du marché) présents sur un marché donné par rapport à sa taille ou à sa valeur marchande totale.
Les principales entreprises opérant sur le marché des services de test de dispositifs médicaux sont :
- SGS SA
- Eurofins
- Toxique
- Services d'analyse Pace, LLC
- Groupe Intertek plc
Avis de non-responsabilité : les sociétés répertoriées ci-dessus ne sont pas classées dans un ordre particulier.
- Obtenez un aperçu des principaux acteurs du marché des services de test de dispositifs médicaux
Informations basées sur les phases
En fonction de la phase, le marché des services de test des dispositifs médicaux dans le secteur de la santé est segmenté en préclinique et clinique. En 2018, le segment préclinique détenait une part de marché considérable de 68,17 % du marché des services de test des dispositifs médicaux, par phase.
Les acteurs du marché des services de test de dispositifs médicaux sur le marché de la santé adoptent des stratégies de lancement et d'expansion de produits pour répondre aux demandes changeantes des clients dans le monde entier, ce qui leur permet également de maintenir leur nom de marque à l'échelle mondiale.
Services de test de dispositifs médicaux sur le marché de la santé – par service
- Test de biocompatibilité
- Test de chimie
- Microbiologie et tests de stérilité
- Validation du package
Services de test de dispositifs médicaux sur le marché de la santé – par phase
- Préclinique
- Clinique
Services de test de dispositifs médicaux sur le marché de la santé – par géographie
Amérique du Nord
- NOUS
- Canada
- Mexique
Europe
- France
- Allemagne
- Italie
- ROYAUME-UNI
- Espagne
- Reste de l'Europe
Asie-Pacifique (APAC)
- Chine
- Inde
- Corée du Sud
- Japon
- Australie
- Reste de l'APAC
Moyen-Orient et Afrique (MEA)
- Afrique du Sud
- Arabie Saoudite
- Émirats arabes unis
- Reste de la MEA
Amérique du Sud et Amérique centrale (SCAM)
- Brésil
- Argentine
- Reste de SCAM
Profils d'entreprise
- SGS SA
- Eurofins
- Toxique
- Services d'analyse Pace, LLC
- Groupe Intertek plc
- ASSOCIÉS SCIENTIFIQUES NORD-AMÉRICAINS INC.
- Rivière Charles
- Application WuXi AppTec
- Technologie des matériaux élémentaires
- TÜV SÜD AG
- Analyse historique (2 ans), année de base, prévision (7 ans) avec TCAC
- Analyse PEST et SWO
- Taille du marché Valeur / Volume - Mondial, Régional, Pays
- Industrie et paysage concurrentiel
- Ensemble de données Excel

Report Coverage
Revenue forecast, Company Analysis, Industry landscape, Growth factors, and Trends
Segment Covered
This text is related
to segments covered.

Regional Scope
North America, Europe, Asia Pacific, Middle East & Africa, South & Central America
Country Scope
This text is related
to country scope.
Trends and growth analysis reports related to Life Sciences : READ MORE..
The List of Companies
- SGS SA
- Eurofins
- Toxikon
- Pace Analytical Services, LLC
- Intertek Group plc
- NORTH AMERICAN SCIENCE ASSOCIATES INC.
- Charles River
- WuXi AppTec
- Element Materials Technology
- TÜV SÜD AG
The Insight Partners performs research in 4 major stages: Data Collection & Secondary Research, Primary Research, Data Analysis and Data Triangulation & Final Review.
- Data Collection and Secondary Research:
As a market research and consulting firm operating from a decade, we have published and advised several client across the globe. First step for any study will start with an assessment of currently available data and insights from existing reports. Further, historical and current market information is collected from Investor Presentations, Annual Reports, SEC Filings, etc., and other information related to company’s performance and market positioning are gathered from Paid Databases (Factiva, Hoovers, and Reuters) and various other publications available in public domain.
Several associations trade associates, technical forums, institutes, societies and organization are accessed to gain technical as well as market related insights through their publications such as research papers, blogs and press releases related to the studies are referred to get cues about the market. Further, white papers, journals, magazines, and other news articles published in last 3 years are scrutinized and analyzed to understand the current market trends.
- Primary Research:
The primarily interview analysis comprise of data obtained from industry participants interview and answers to survey questions gathered by in-house primary team.
For primary research, interviews are conducted with industry experts/CEOs/Marketing Managers/VPs/Subject Matter Experts from both demand and supply side to get a 360-degree view of the market. The primary team conducts several interviews based on the complexity of the markets to understand the various market trends and dynamics which makes research more credible and precise.
A typical research interview fulfils the following functions:
- Provides first-hand information on the market size, market trends, growth trends, competitive landscape, and outlook
- Validates and strengthens in-house secondary research findings
- Develops the analysis team’s expertise and market understanding
Primary research involves email interactions and telephone interviews for each market, category, segment, and sub-segment across geographies. The participants who typically take part in such a process include, but are not limited to:
- Industry participants: VPs, business development managers, market intelligence managers and national sales managers
- Outside experts: Valuation experts, research analysts and key opinion leaders specializing in the electronics and semiconductor industry.
Below is the breakup of our primary respondents by company, designation, and region:
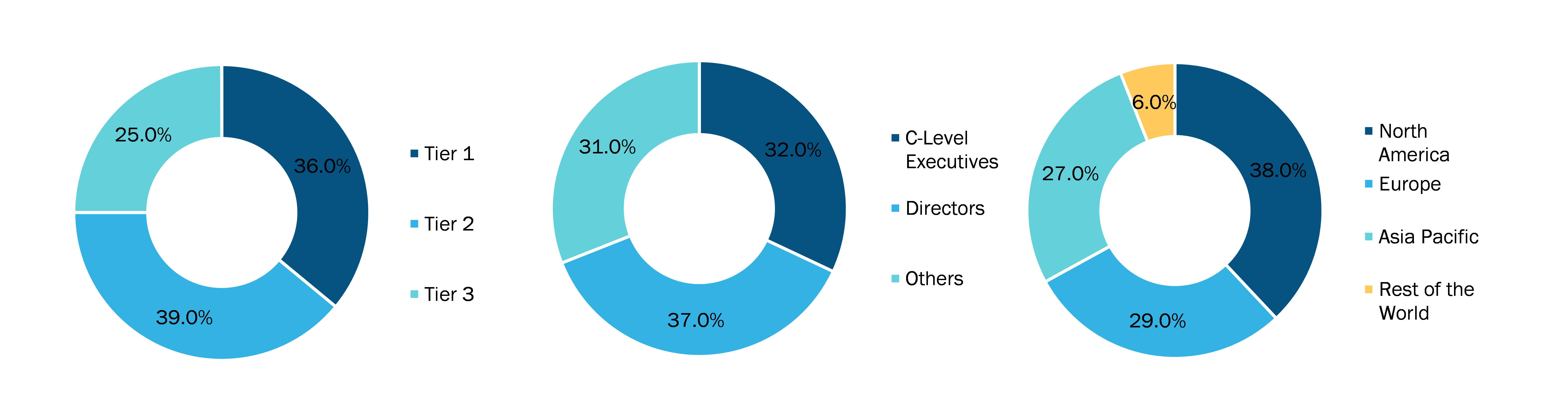
Once we receive the confirmation from primary research sources or primary respondents, we finalize the base year market estimation and forecast the data as per the macroeconomic and microeconomic factors assessed during data collection.
- Data Analysis:
Once data is validated through both secondary as well as primary respondents, we finalize the market estimations by hypothesis formulation and factor analysis at regional and country level.
- Macro-Economic Factor Analysis:
We analyse macroeconomic indicators such the gross domestic product (GDP), increase in the demand for goods and services across industries, technological advancement, regional economic growth, governmental policies, the influence of COVID-19, PEST analysis, and other aspects. This analysis aids in setting benchmarks for various nations/regions and approximating market splits. Additionally, the general trend of the aforementioned components aid in determining the market's development possibilities.
- Country Level Data:
Various factors that are especially aligned to the country are taken into account to determine the market size for a certain area and country, including the presence of vendors, such as headquarters and offices, the country's GDP, demand patterns, and industry growth. To comprehend the market dynamics for the nation, a number of growth variables, inhibitors, application areas, and current market trends are researched. The aforementioned elements aid in determining the country's overall market's growth potential.
- Company Profile:
The “Table of Contents” is formulated by listing and analyzing more than 25 - 30 companies operating in the market ecosystem across geographies. However, we profile only 10 companies as a standard practice in our syndicate reports. These 10 companies comprise leading, emerging, and regional players. Nonetheless, our analysis is not restricted to the 10 listed companies, we also analyze other companies present in the market to develop a holistic view and understand the prevailing trends. The “Company Profiles” section in the report covers key facts, business description, products & services, financial information, SWOT analysis, and key developments. The financial information presented is extracted from the annual reports and official documents of the publicly listed companies. Upon collecting the information for the sections of respective companies, we verify them via various primary sources and then compile the data in respective company profiles. The company level information helps us in deriving the base number as well as in forecasting the market size.
- Developing Base Number:
Aggregation of sales statistics (2020-2022) and macro-economic factor, and other secondary and primary research insights are utilized to arrive at base number and related market shares for 2022. The data gaps are identified in this step and relevant market data is analyzed, collected from paid primary interviews or databases. On finalizing the base year market size, forecasts are developed on the basis of macro-economic, industry and market growth factors and company level analysis.
- Data Triangulation and Final Review:
The market findings and base year market size calculations are validated from supply as well as demand side. Demand side validations are based on macro-economic factor analysis and benchmarks for respective regions and countries. In case of supply side validations, revenues of major companies are estimated (in case not available) based on industry benchmark, approximate number of employees, product portfolio, and primary interviews revenues are gathered. Further revenue from target product/service segment is assessed to avoid overshooting of market statistics. In case of heavy deviations between supply and demand side values, all thes steps are repeated to achieve synchronization.
We follow an iterative model, wherein we share our research findings with Subject Matter Experts (SME’s) and Key Opinion Leaders (KOLs) until consensus view of the market is not formulated – this model negates any drastic deviation in the opinions of experts. Only validated and universally acceptable research findings are quoted in our reports.
We have important check points that we use to validate our research findings – which we call – data triangulation, where we validate the information, we generate from secondary sources with primary interviews and then we re-validate with our internal data bases and Subject matter experts. This comprehensive model enables us to deliver high quality, reliable data in shortest possible time.

 Obtenez un échantillon gratuit pour ce rapport
Obtenez un échantillon gratuit pour ce rapport