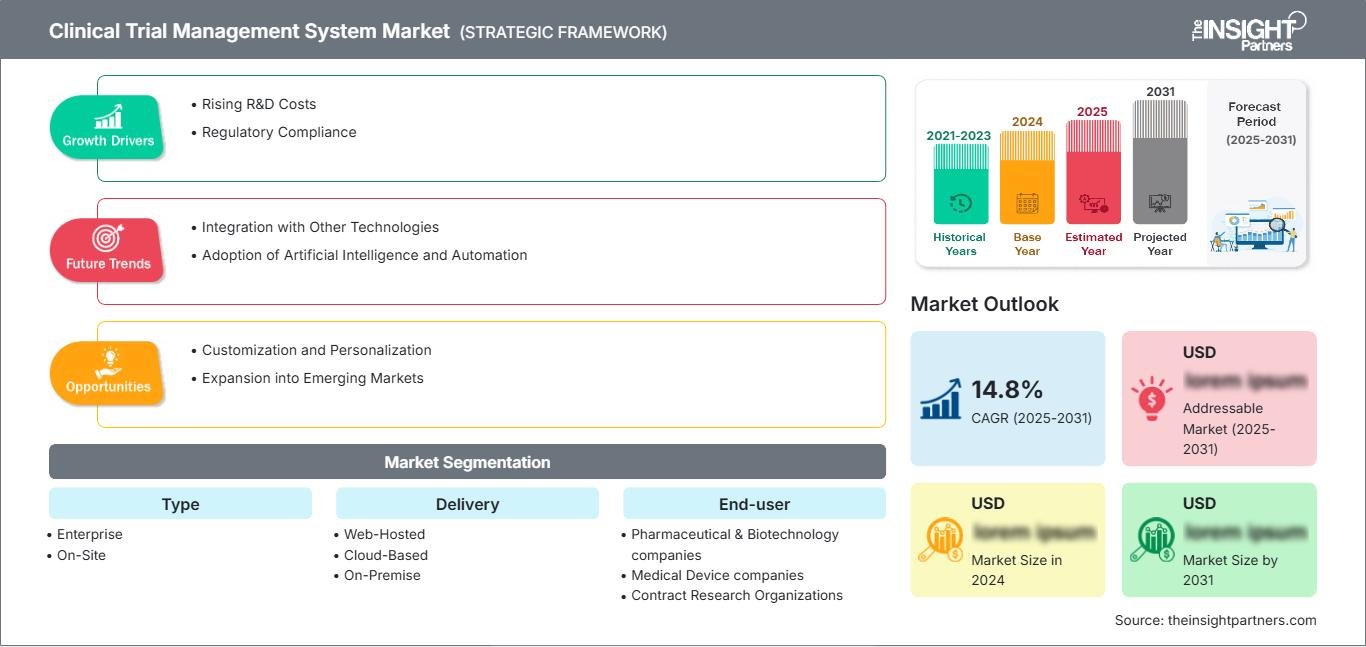
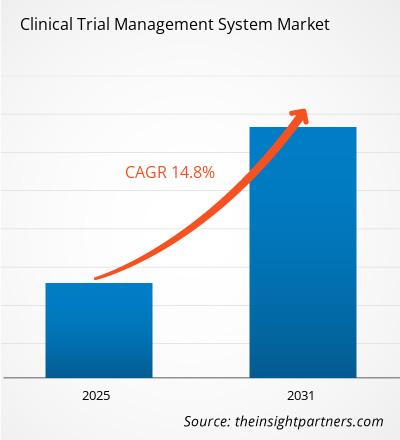
Si prevede che il mercato dei sistemi di gestione degli studi clinici registrerà un CAGR del 14,8% dal 2025 al 2031, con una dimensione del mercato in espansione da XX milioni di dollari nel 2024 a XX milioni di dollari entro il 2031.
Il rapporto è segmentato per tipologia (aziendale e on-site); distribuzione (web-hosted, basata su cloud e on-premise); utente finale (aziende farmaceutiche e biotecnologiche, aziende di dispositivi medici, organizzazioni di ricerca a contratto [CRO] e altri). L'analisi globale è ulteriormente suddivisa a livello regionale e per i principali paesi. Il rapporto offre il valore in USD per l'analisi e i segmenti sopra indicati.
Scopo del rapporto
Il rapporto "Clinical Trial Management System Market" di The Insight Partners mira a descrivere il panorama attuale e la crescita futura, i principali fattori trainanti, le sfide e le opportunità. Ciò fornirà spunti a vari stakeholder aziendali, come:
- Fornitori/produttori di tecnologia: per comprendere le dinamiche di mercato in evoluzione e conoscere le potenziali opportunità di crescita, consentendo loro di prendere decisioni strategiche informate.
- Investitori: per condurre un'analisi completa delle tendenze in merito al tasso di crescita del mercato, alle proiezioni finanziarie del mercato e alle opportunità esistenti lungo la catena del valore.
- Organismi di regolamentazione: per regolamentare le politiche e le attività di controllo nel mercato con l'obiettivo di ridurre al minimo gli abusi, preservare la fiducia degli investitori e sostenere l'integrità e la stabilità del mercato.
Tipo di segmentazione del mercato dei sistemi di gestione degli studi clinici
- Impresa
- In loco
Consegna
- Ospitato sul Web
- Basato su cloud
- In sede
Utente finale
- Aziende farmaceutiche e biotecnologiche
- Aziende di dispositivi medici
- Organizzazioni di ricerca a contratto
Geografia
- Nord America
- Europa
- Asia Pacifico
- Medio Oriente e Africa
- America meridionale e centrale
Potrai personalizzare gratuitamente qualsiasi rapporto, comprese parti di questo rapporto, o analisi a livello di paese, pacchetto dati Excel, oltre a usufruire di grandi offerte e sconti per start-up e università
Mercato dei sistemi di gestione degli studi clinici: Approfondimenti strategici
-
Ottieni le principali tendenze chiave del mercato di questo rapporto.Questo campione GRATUITO includerà l'analisi dei dati, che vanno dalle tendenze di mercato alle stime e alle previsioni.
Fattori di crescita del mercato dei sistemi di gestione degli studi clinici
- Aumento dei costi di ricerca e sviluppo: si registra un aumento degli investimenti nelle attività di ricerca e sviluppo per gli studi clinici. Questo fattore porta all'adozione di soluzioni digitali che gestiscono in modo efficiente i processi di sperimentazione clinica. Inoltre, l'aumento dei costi di ricerca e sviluppo incoraggia le organizzazioni ad adottare sistemi avanzati di gestione degli studi clinici.
- Conformità normativa: il crescente controllo normativo e la necessità di conformità alle linee guida di buona pratica clinica (GCP) richiedono l'adozione di sistemi robusti per il monitoraggio e la documentazione degli studi.
Tendenze future del mercato dei sistemi di gestione degli studi clinici
- Integrazione con altre tecnologie: si assisterà a una maggiore integrazione dei sistemi di gestione degli studi clinici con tecnologie come l'acquisizione elettronica dei dati (EDC), le cartelle cliniche elettroniche (EHR) e altri sistemi clinici per creare un flusso di lavoro fluido. Le tecnologie di integrazione per risultati migliori porteranno alla crescita del mercato nei prossimi anni.
- Adozione di intelligenza artificiale e automazione: l'adozione di algoritmi di intelligenza artificiale e apprendimento automatico migliorerà la gestione dei dati, il reclutamento dei pazienti e l'analisi. Questo fattore rende il sistema di gestione degli studi clinici più efficiente ed efficace.
Opportunità di mercato per i sistemi di gestione degli studi clinici
- Personalizzazione: offrire soluzioni personalizzabili su misura per specifiche esigenze di settore, come l'oncologia o le malattie rare, può offrire ai fornitori un vantaggio competitivo. Per ottenere un vantaggio competitivo, gli operatori del mercato possono adottare il sistema di gestione degli studi clinici.
- Espansione nei mercati emergenti: poiché i sistemi sanitari dei paesi in via di sviluppo stanno adottando ampiamente soluzioni digitali, vi sono opportunità di crescita del mercato, in quanto possono fornire servizi di sperimentazione clinica avanzati ai propri utenti finali.
Approfondimenti regionali sul mercato dei sistemi di gestione degli studi clinici
Le tendenze regionali e i fattori che influenzano il mercato dei sistemi di gestione degli studi clinici durante il periodo di previsione sono stati ampiamente spiegati dagli analisti di The Insight Partners. Questa sezione illustra anche i segmenti e la geografia del mercato dei sistemi di gestione degli studi clinici in Nord America, Europa, Asia-Pacifico, Medio Oriente e Africa, America meridionale e centrale.
Ambito del rapporto di mercato sui sistemi di gestione degli studi clinici
| Attributo del rapporto | Dettagli |
|---|---|
| Dimensioni del mercato in 2024 | US$ XX million |
| Dimensioni del mercato per 2031 | US$ XX Million |
| CAGR globale (2025 - 2031) | 14.8% |
| Dati storici | 2021-2023 |
| Periodo di previsione | 2025-2031 |
| Segmenti coperti |
By Tipo
|
| Regioni e paesi coperti |
Nord America
|
| Leader di mercato e profili aziendali chiave |
|
Densità degli attori del mercato dei sistemi di gestione degli studi clinici: comprendere il suo impatto sulle dinamiche aziendali
Il mercato dei sistemi di gestione degli studi clinici è in rapida crescita, trainato dalla crescente domanda degli utenti finali, dovuta a fattori quali l'evoluzione delle preferenze dei consumatori, i progressi tecnologici e una maggiore consapevolezza dei benefici del prodotto. Con l'aumento della domanda, le aziende stanno ampliando la propria offerta, innovando per soddisfare le esigenze dei consumatori e sfruttando le tendenze emergenti, alimentando ulteriormente la crescita del mercato.
- Ottieni il Mercato dei sistemi di gestione degli studi clinici Panoramica dei principali attori chiave
Punti di forza
- Copertura completa: il rapporto copre in modo completo l'analisi di prodotti, servizi, tipologie e utenti finali del mercato dei sistemi di gestione degli studi clinici, fornendo un panorama olistico.
- Analisi degli esperti: il rapporto è compilato sulla base della conoscenza approfondita di esperti e analisti del settore.
- Informazioni aggiornate: il rapporto garantisce rilevanza aziendale grazie alla sua copertura di informazioni recenti e tendenze dei dati.
- Opzioni di personalizzazione: questo rapporto può essere personalizzato per soddisfare le esigenze specifiche del cliente e adattarsi in modo appropriato alle strategie aziendali.
Il rapporto di ricerca sul mercato dei sistemi di gestione degli studi clinici può, quindi, aiutare a guidare il percorso di decodificazione e comprensione dello scenario del settore e delle prospettive di crescita. Sebbene possano esserci alcune preoccupazioni valide, i vantaggi complessivi di questo rapporto tendono a superare gli svantaggi.
- Analisi storica (2 anni), anno base, previsione (7 anni) con CAGR
- Analisi PEST e SWOT
- Valore/volume delle dimensioni del mercato - Globale, Regionale, Nazionale
- Industria e panorama competitivo
- Set di dati Excel
Report recenti
Rapporti correlati
Testimonianze
Motivo dell'acquisto
- Processo decisionale informato
- Comprensione delle dinamiche di mercato
- Analisi competitiva
- Analisi dei clienti
- Previsioni di mercato
- Mitigazione del rischio
- Pianificazione strategica
- Giustificazione degli investimenti
- Identificazione dei mercati emergenti
- Miglioramento delle strategie di marketing
- Aumento dell'efficienza operativa
- Allineamento alle tendenze normative





















 Ottieni un campione gratuito per - Mercato dei sistemi di gestione degli studi clinici
Ottieni un campione gratuito per - Mercato dei sistemi di gestione degli studi clinici