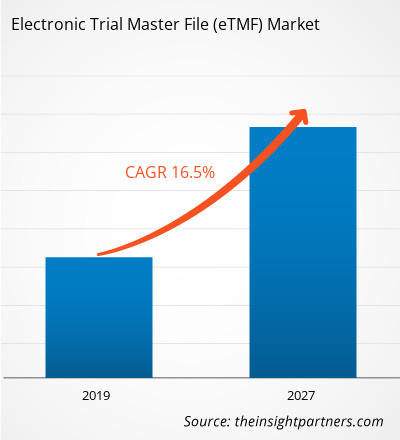
[Rapporto di ricerca] Il mercato dei file master di sperimentazione elettronica nel settore sanitario è stato valutato a 938,32 milioni di dollari nel 2018 e si prevede che raggiungerà i 3.155,64 milioni di dollari entro il 2027; si prevede che crescerà a un CAGR del 16,5% dal 2019 al 2027.
I sistemi Electronic Trial Master File (eTMF) possono essere definiti come un'integrazione di componenti software e hardware collettivamente responsabili della gestione ottimale dei dati degli studi clinici. Queste soluzioni aiutano a semplificare i dati generati durante uno studio clinico in un formato digitale facile da archiviare, che può essere recuperato da utenti diversi, il che è vantaggioso in termini di facile accessibilità e riduzione dei costi associati alle operazioni amministrative e di manutenzione manuale dei dati negli studi clinici. La crescita dell'Electronic Trial Master File nel mercato sanitario è attribuita all'aumento del numero di studi clinici, alla crescente prevalenza di malattie e al progresso tecnologico che ha dato impulso al mercato nel corso degli anni. Tuttavia, è probabile che la carenza di professionisti qualificati abbia un impatto negativo sulla crescita del mercato nei prossimi anni. D'altro canto, è probabile che le crescenti iniziative strategiche da parte degli operatori del mercato forniscano opportunità di crescita nei prossimi anni.
Si prevede che l' Electronic Trial Master File nel mercato sanitario registrerà una crescita sostanziale dopo la pandemia. Il COVID-19 ha colpito economie e settori in vari paesi a causa di blocchi, divieti di viaggio e chiusure aziendali. La crisi del COVID-19 ha sovraccaricato i sistemi sanitari pubblici in molti paesi e ha evidenziato la forte necessità di investimenti sostenibili nei sistemi sanitari. Con l'avanzare della pandemia di COVID-19, si prevede che il settore sanitario registrerà un calo della crescita. Il segmento delle scienze della vita prospera grazie alla crescente domanda di prodotti diagnostici in vitro e alle crescenti attività di ricerca e sviluppo in tutto il mondo. Tuttavia, il segmento delle tecnologie mediche e dell'imaging sta assistendo a un calo delle vendite dovuto a un numero inferiore di interventi chirurgici eseguiti e a un approvvigionamento di apparecchiature ritardato o prolungato. Inoltre, si prevede che le consultazioni virtuali da parte di professionisti sanitari diventeranno il modello di erogazione delle cure mainstream dopo la pandemia. Con la telemedicina che trasforma l'erogazione delle cure, la salute digitale continuerà a prosperare negli anni a venire. Inoltre, si prevede che anche le sperimentazioni cliniche interrotte e il conseguente ritardo nei lanci di farmaci apriranno la strada a sperimentazioni completamente virtuali in futuro. Si prevede che nuove tecnologie come l'mRNA emergeranno e rivoluzioneranno l'industria farmaceutica e si prevede che nei prossimi anni il mercato assisterà a una maggiore integrazione verticale e a joint venture.
Personalizza questo report in base alle tue esigenze
Riceverai la personalizzazione gratuita di qualsiasi report, comprese parti di questo report, o analisi a livello nazionale, pacchetto dati Excel, oltre a usufruire di grandi offerte e sconti per start-up e università
- Scopri le principali tendenze di mercato in questo rapporto.Questo campione GRATUITO includerà analisi di dati che spaziano dalle tendenze di mercato alle stime e alle previsioni.
Approfondimenti di mercato
Le crescenti applicazioni del file master di sperimentazione elettronica nel settore sanitario guideranno la crescita del mercato del file master di sperimentazione elettronica nel settore sanitario
La ricerca e sviluppo (R&S) sono una parte significativa ed essenziale del business di un'azienda. Le operazioni dell'industria farmaceutica hanno un impatto socioeconomico significativo sulla società sotto forma di investimenti in R&S e produzione. La ricerca e sviluppo sono la "spina dorsale" di qualsiasi sistema di scoperta di farmaci per il successo e il file master elettronico di sperimentazione è un software essenziale nella ricerca e sviluppo di nuove entità terapeutiche basate su farmaci e biotecnologie. Le aziende farmaceutiche e biotecnologiche si concentrano principalmente sulla ricerca e sviluppo (R&S) per ideare nuove molecole per varie applicazioni terapeutiche con il potenziale medico e commerciale più significativo. Le aziende investono principalmente in R&S con l'intenzione di fornire al mercato prodotti innovativi e di alta qualità. Ad esempio, la spesa globale in R&S nel 2017 è aumentata del 3,9 percento a 165 miliardi di dollari rispetto al 2016. La spesa media in R&S è aumentata moderatamente al 20,9 percento come percentuale delle vendite totali di farmaci da prescrizione. Inoltre, secondo un sondaggio annuale condotto tra i membri della PhRMA, nel 2017 le aziende farmaceutiche hanno dichiarato di aver speso 71,4 miliardi di dollari in ricerca e sviluppo.
Le aziende farmaceutiche hanno investito di più in R&S per accelerare il loro processo di sperimentazione clinica. Ad esempio, al 30 giugno 2019, AstraZeneca ha aperto la strada spendendo il 25,63% dei ricavi in ricerca e sviluppo, al 31 marzo 2019, Holding strong, Eli Lilly and Company ha speso il 22,38% dei suoi ricavi in R&S e al 30 giugno 2019, Roche Holding AG non era molto indietro con il 21,29% speso in R&S.
Le spese di ricerca e sviluppo sono solitamente sostenute durante i processi di scoperta, test e sviluppo di nuovi prodotti, pagamenti anticipati e milestone, miglioramento dei risultati esistenti, nonché dimostrazione dell'efficacia del prodotto e della conformità normativa prima del lancio. Inoltre, gli investimenti per R&S da parte delle aziende farmaceutiche negli Stati Uniti sono cresciuti costantemente negli ultimi 15 anni.
Lo sviluppo e la scoperta di farmaci sono un processo lungo e costoso. Il processo dalla rilevazione precoce o progettazione allo sviluppo fino all'approvazione normativa può richiedere più di 10-15 anni. Durante la fase di sviluppo di una sostanza farmacologica, sono richiesti vari servizi di test per verificare la qualità e l'efficacia del prodotto. Pertanto, le aziende farmaceutiche e biotecnologiche preferiscono salvare i dati in un file master elettronico per risparmiare sui costi e sui tempi, il che dovrebbe guidare la crescita del mercato.
Gli studi clinici sono uno dei passaggi più importanti e significativi nella scoperta di farmaci, indipendentemente dal fatto che il trattamento, la strategia medica o il dispositivo siano sicuri ed efficaci per l'uso umano e veterinario. Gli studi clinici aiutano a comprendere e determinare i migliori approcci al trattamento per determinati campi della terapia. Gli studi clinici vengono eseguiti specificamente per raccogliere dati sulla sicurezza e l'efficacia dello sviluppo di un nuovo prodotto e strumento. Prima che le autorità di regolamentazione approvino le molecole del farmaco e i dispositivi medici, vengono eseguiti una serie di studi clinici. La crescente prevalenza di varie malattie trasmissibili e non trasmissibili sta aumentando la domanda di sviluppo di nuovi farmaci o dispositivi medici per il trattamento. Ciò a sua volta dovrebbe aumentare la domanda di attività di sperimentazione clinica per varie aree terapeutiche.
Le aziende biofarmaceutiche e farmaceutiche coinvolte in sperimentazioni cliniche mirano a passare da sistemi di gestione dei documenti cartacei in schedari a sistemi di gestione dei documenti elettronici in cui i documenti vengono archiviati in archivi elettronici online. Implementando un sistema eTMF completo che consente alle organizzazioni di automatizzare, acquisire e gestire i documenti TMF e registra rischi inutili e può spesso realizzare risparmi sui costi delle sperimentazioni cliniche rispetto ai processi di gestione manuale della carta.
Un aumento nell'adozione di un sistema di file master di sperimentazione elettronica nel processo clinico probabilmente stimolerà il mercato. Ad esempio, NextDocs di Aurea Software è un forum di file master di sperimentazione elettronica (eTMF) per la cooperazione clinica nella gestione delle cartelle cliniche. È un sistema di gestione dei contenuti per l'industria farmaceutica che offre un mezzo formalizzato per organizzare e archiviare documenti, fotografie e altri contenuti digitali per le sperimentazioni cliniche farmaceutiche che potrebbero essere richiesti per conformarsi alle agenzie di regolamentazione governative. Nelle sperimentazioni cliniche, l'EMA supporta pienamente l'uso di sistemi eTMF per l'archiviazione elettronica come sostituto della carta. L'agenzia cita problemi di qualità con TMF ed eTMF in una dichiarazione cautelativa dovuti al contenuto cartaceo e incongruenze come pagine mancanti, etichettatura non idonea o documenti incompleti. Grazie alle caratteristiche innovative di eTMF come la centralizzazione e la gestione della documentazione delle sperimentazioni cliniche, potenti capacità di ricerca (con metadati) e molteplici metodi di aggiunta di documenti, eTMF sta diventando importante per l'efficienza aziendale, i risparmi sui costi e le tempistiche ridotte per la produzione di prodotti BioPharma per implementare processi di gestione dei documenti elettronici. Il segreto per introdurre framework eTMF interoperabili è l'uso di un modello di contenuto comune, standard basati sul vocabolario e tecnologie di standard basati sul Web.
Grazie al progresso del trial master file verso il trial master file elettronico, l'organizzazione di ricerca a contratto e le aziende farmaceutiche e biotecnologiche stanno adottando l'eTMF per una migliore gestione dei dati clinici e del processo di gestione delle sperimentazioni cliniche. Le ragioni e i fattori sopra menzionati sono dovuti all'aumento della crescita del mercato del trial master file elettronico.
Approfondimenti basati sui componenti
In termini di componenti, l'Electronic Trial Master File nel mercato sanitario è segmentato in servizi e software. Il segmento dei servizi ha detenuto la quota maggiore del mercato nel 2019.
Informazioni basate sulla modalità di consegna
In base alla modalità di consegna, l'Electronic Trial Master File nel mercato sanitario è segmentato in etmf basati su cloud ed etmf on-premise. Il segmento eTMF basato su cloud ha detenuto la quota maggiore del mercato nel 2019.
Informazioni basate sull'utente finale
In termini di utente finale, l'Electronic Trial Master File nel mercato sanitario è segmentato in aziende farmaceutiche e biotecnologiche, cros e altre. Il segmento delle aziende farmaceutiche e biotecnologiche ha detenuto la quota maggiore del mercato nel 2019.
Gli operatori del mercato sanitario stanno adottando strategie di lancio ed espansione dei prodotti per soddisfare le mutevoli esigenze dei clienti in tutto il mondo, il che consente loro anche di mantenere il proprio marchio a livello globale.
Approfondimenti regionali sul mercato del file master di prova elettronico (eTMF)
Le tendenze regionali e i fattori che influenzano il mercato Electronic Trial Master File (eTMF) durante il periodo di previsione sono stati ampiamente spiegati dagli analisti di Insight Partners. Questa sezione discute anche i segmenti di mercato Electronic Trial Master File (eTMF) e la geografia in Nord America, Europa, Asia Pacifico, Medio Oriente e Africa e Sud e Centro America.
- Ottieni i dati specifici regionali per il mercato dei file master di prova elettronici (eTMF)
Ambito del rapporto di mercato sui file master di prova elettronici (eTMF)
| Attributo del report | Dettagli |
|---|---|
| Dimensioni del mercato nel 2018 | 938,32 milioni di dollari USA |
| Dimensioni del mercato entro il 2027 | 3.155,64 milioni di dollari USA |
| CAGR globale (2018 - 2027) | 16,5% |
| Dati storici | 2016-2017 |
| Periodo di previsione | 2019-2027 |
| Segmenti coperti | Per componente
|
| Regioni e Paesi coperti | America del Nord
|
| Leader di mercato e profili aziendali chiave |
|
Densità degli attori del mercato dell'Electronic Trial Master File (eTMF): comprendere il suo impatto sulle dinamiche aziendali
Il mercato del mercato Electronic Trial Master File (eTMF) sta crescendo rapidamente, spinto dalla crescente domanda degli utenti finali dovuta a fattori quali l'evoluzione delle preferenze dei consumatori, i progressi tecnologici e una maggiore consapevolezza dei vantaggi del prodotto. Con l'aumento della domanda, le aziende stanno ampliando le loro offerte, innovando per soddisfare le esigenze dei consumatori e capitalizzando sulle tendenze emergenti, il che alimenta ulteriormente la crescita del mercato.
La densità degli operatori di mercato si riferisce alla distribuzione di aziende o società che operano in un particolare mercato o settore. Indica quanti concorrenti (operatori di mercato) sono presenti in un dato spazio di mercato in relazione alle sue dimensioni o al valore di mercato totale.
Le principali aziende che operano nel mercato dell'Electronic Trial Master File (eTMF) sono:
- Aurea, Inc.
- TRASPERFETTO
- Covance Inc (Lab Corp)
- Oracolo
- Innovazione
Disclaimer : le aziende elencate sopra non sono classificate secondo un ordine particolare.
- Ottieni la panoramica dei principali attori del mercato Electronic Trial Master File (eTMF)
File master di prova elettronico nel mercato sanitario – per componente
- Servizio
- Software
File master di prova elettronico nel mercato sanitario – per modalità di consegna
- eTMF basato su cloud
- eTMF in sede
File master di sperimentazione elettronica nel mercato sanitario – per utente finale
- Aziende farmaceutiche e biotecnologiche
- CRO
- Altri
File master di prova elettronico nel mercato sanitario – per area geografica
America del Nord
- NOI
- Canada
- Messico
Europa
- Francia
- Germania
- Italia
- Regno Unito
- Spagna
- Resto d'Europa
Asia Pacifico (APAC)
- Cina
- India
- Corea del Sud
- Giappone
- Australia
- Resto dell'APAC
Medio Oriente e Africa (MEA)
- Sudafrica
- Arabia Saudita
- Emirati Arabi Uniti
- Resto del MEA
America del Sud e America Centrale (SCAM)
- Brasile
- Argentina
- Resto della TRUFFA
Profili aziendali
- Aurea, Inc.
- Transperfetto.
- Covance Inc (Lab Corp)
- Oracolo
- Innovazione
- Società a responsabilità limitata
- Omnicomunicazione
- Farmacovigilanza
- Sistemi Veeva
- Phlexglobale
- Analisi storica (2 anni), anno base, previsione (7 anni) con CAGR
- Analisi PEST e SWOT
- Valore/volume delle dimensioni del mercato - Globale, regionale, nazionale
- Industria e panorama competitivo
- Set di dati Excel

Report Coverage
Revenue forecast, Company Analysis, Industry landscape, Growth factors, and Trends
Segment Covered
This text is related
to segments covered.

Regional Scope
North America, Europe, Asia Pacific, Middle East & Africa, South & Central America
Country Scope
This text is related
to country scope.
Domande frequenti
Pharmaceutical and biotechnology companies, contract research organizations (CROs) and other users can make use of electronic trial master file (eTMF).
Increasing in number of clinical trial, increasing prevalence of diseases and technology advancement have been boosting the market over the years. However, dearth of skilled professionals is likely to have a negative impact on the growth of the market in the coming years. On the other hand, increasing strategic initiatives by market players is likely to provide growth opportunities over the coming years.
Electronic trial master file (eTMF) systems can be defined as an integration of software and hardware components collectively responsible for the optimal management of clinical trial data. These solutions help to streamline the data generated during the course of a clinical trial in an easy-to-store digital format, which can be retrieved by dissimilar users beneficial in easy accessibility and reduction the cost associated with the administrative and manual data maintenance operations in clinical trials.
Trends and growth analysis reports related to Technology, Media and Telecommunications : READ MORE..
The List of Companies - Electronic Trial Master File (eTMF) Market
- Aurea, Inc.
- TRANSPERFECT
- Covance Inc (Lab Corp)
- Oracle
- Ennov
- Mastercontrol, Inc.
- Omnicomm
- Pharmavigilalnce
- Veeva Systems
- Phlexglobal
The Insight Partners performs research in 4 major stages: Data Collection & Secondary Research, Primary Research, Data Analysis and Data Triangulation & Final Review.
- Data Collection and Secondary Research:
As a market research and consulting firm operating from a decade, we have published and advised several client across the globe. First step for any study will start with an assessment of currently available data and insights from existing reports. Further, historical and current market information is collected from Investor Presentations, Annual Reports, SEC Filings, etc., and other information related to company’s performance and market positioning are gathered from Paid Databases (Factiva, Hoovers, and Reuters) and various other publications available in public domain.
Several associations trade associates, technical forums, institutes, societies and organization are accessed to gain technical as well as market related insights through their publications such as research papers, blogs and press releases related to the studies are referred to get cues about the market. Further, white papers, journals, magazines, and other news articles published in last 3 years are scrutinized and analyzed to understand the current market trends.
- Primary Research:
The primarily interview analysis comprise of data obtained from industry participants interview and answers to survey questions gathered by in-house primary team.
For primary research, interviews are conducted with industry experts/CEOs/Marketing Managers/VPs/Subject Matter Experts from both demand and supply side to get a 360-degree view of the market. The primary team conducts several interviews based on the complexity of the markets to understand the various market trends and dynamics which makes research more credible and precise.
A typical research interview fulfils the following functions:
- Provides first-hand information on the market size, market trends, growth trends, competitive landscape, and outlook
- Validates and strengthens in-house secondary research findings
- Develops the analysis team’s expertise and market understanding
Primary research involves email interactions and telephone interviews for each market, category, segment, and sub-segment across geographies. The participants who typically take part in such a process include, but are not limited to:
- Industry participants: VPs, business development managers, market intelligence managers and national sales managers
- Outside experts: Valuation experts, research analysts and key opinion leaders specializing in the electronics and semiconductor industry.
Below is the breakup of our primary respondents by company, designation, and region:
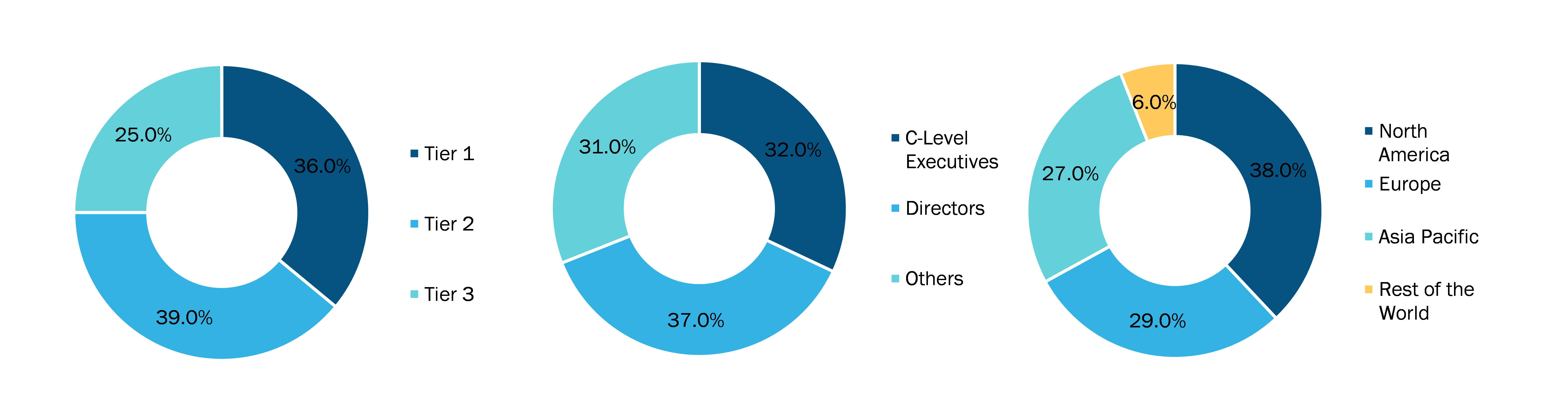
Once we receive the confirmation from primary research sources or primary respondents, we finalize the base year market estimation and forecast the data as per the macroeconomic and microeconomic factors assessed during data collection.
- Data Analysis:
Once data is validated through both secondary as well as primary respondents, we finalize the market estimations by hypothesis formulation and factor analysis at regional and country level.
- Macro-Economic Factor Analysis:
We analyse macroeconomic indicators such the gross domestic product (GDP), increase in the demand for goods and services across industries, technological advancement, regional economic growth, governmental policies, the influence of COVID-19, PEST analysis, and other aspects. This analysis aids in setting benchmarks for various nations/regions and approximating market splits. Additionally, the general trend of the aforementioned components aid in determining the market's development possibilities.
- Country Level Data:
Various factors that are especially aligned to the country are taken into account to determine the market size for a certain area and country, including the presence of vendors, such as headquarters and offices, the country's GDP, demand patterns, and industry growth. To comprehend the market dynamics for the nation, a number of growth variables, inhibitors, application areas, and current market trends are researched. The aforementioned elements aid in determining the country's overall market's growth potential.
- Company Profile:
The “Table of Contents” is formulated by listing and analyzing more than 25 - 30 companies operating in the market ecosystem across geographies. However, we profile only 10 companies as a standard practice in our syndicate reports. These 10 companies comprise leading, emerging, and regional players. Nonetheless, our analysis is not restricted to the 10 listed companies, we also analyze other companies present in the market to develop a holistic view and understand the prevailing trends. The “Company Profiles” section in the report covers key facts, business description, products & services, financial information, SWOT analysis, and key developments. The financial information presented is extracted from the annual reports and official documents of the publicly listed companies. Upon collecting the information for the sections of respective companies, we verify them via various primary sources and then compile the data in respective company profiles. The company level information helps us in deriving the base number as well as in forecasting the market size.
- Developing Base Number:
Aggregation of sales statistics (2020-2022) and macro-economic factor, and other secondary and primary research insights are utilized to arrive at base number and related market shares for 2022. The data gaps are identified in this step and relevant market data is analyzed, collected from paid primary interviews or databases. On finalizing the base year market size, forecasts are developed on the basis of macro-economic, industry and market growth factors and company level analysis.
- Data Triangulation and Final Review:
The market findings and base year market size calculations are validated from supply as well as demand side. Demand side validations are based on macro-economic factor analysis and benchmarks for respective regions and countries. In case of supply side validations, revenues of major companies are estimated (in case not available) based on industry benchmark, approximate number of employees, product portfolio, and primary interviews revenues are gathered. Further revenue from target product/service segment is assessed to avoid overshooting of market statistics. In case of heavy deviations between supply and demand side values, all thes steps are repeated to achieve synchronization.
We follow an iterative model, wherein we share our research findings with Subject Matter Experts (SME’s) and Key Opinion Leaders (KOLs) until consensus view of the market is not formulated – this model negates any drastic deviation in the opinions of experts. Only validated and universally acceptable research findings are quoted in our reports.
We have important check points that we use to validate our research findings – which we call – data triangulation, where we validate the information, we generate from secondary sources with primary interviews and then we re-validate with our internal data bases and Subject matter experts. This comprehensive model enables us to deliver high quality, reliable data in shortest possible time.

 Ottieni un campione gratuito per questo repot
Ottieni un campione gratuito per questo repot