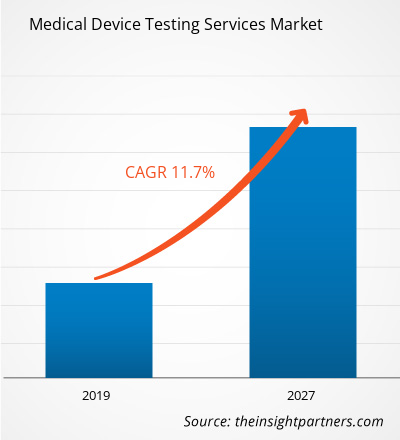
Nel 2018, il mercato dei servizi di collaudo dei dispositivi medici nel settore sanitario è stato valutato 5.505,4 milioni di dollari USA e si prevede che raggiungerà i 14.660,1 milioni di dollari USA entro il 2027; si prevede una crescita a un CAGR dell'11,7% dal 2019 al 2027.
I dispositivi medici sono molto critici in quanto hanno un impatto diretto sulla vita del paziente. Per offrire esperienze di alta qualità e sicure ai pazienti, i produttori di dispositivi medici testano i dispositivi medici prima di consegnarli al mercato. I produttori di dispositivi medici preferiscono eseguire test interni o esternalizzare i servizi di test alle organizzazioni di ricerca a contratto (CRO) per rispettare le severe linee guida normative. Il test dei dispositivi medici serve a garantire la sicurezza, la qualità e la coerenza del servizio durante tutte le fasi di sviluppo e utilizzo del dispositivo medico. Il trattamento medico dipende in larga misura dai dispositivi medici, quindi è importante garantire che il test dei dispositivi medici venga eseguito con la massima competenza. La crescita dei servizi di test dei dispositivi medici nel mercato sanitario è attribuita allo sviluppo di prodotti innovativi, collaborazioni, fusioni e acquisizioni, il rigoroso scenario normativo per l'approvazione dei dispositivi medici sta aumentando la crescita del mercato nel corso degli anni. Inoltre, è probabile che gli sviluppi nel settore dei dispositivi medici abbiano un impatto positivo sulla domanda del mercato durante il periodo di previsione. Tuttavia, la crescita del mercato è frenata da fattori quali interruzioni degli obblighi contrattuali.
Si prevede che il mercato dei servizi di test sui dispositivi medici nel settore sanitario registrerà una crescita sostanziale dopo la pandemia. SGS SA, Eurofins, Toxikon, Pace Analytical Services, LLC, Intertek Group plc, NORTH AMERICAN SCIENCE ASSOCIATES INC., Charles River, WuXi AppTec, Element Materials Technology, TÜV SÜD AG Si prevede che l'mRNA emergerà e rivoluzionerà l'industria farmaceutica e si prevede inoltre che il mercato assisterà a una maggiore integrazione verticale e joint venture nei prossimi anni.
Approfondimenti di mercato
Crescenti applicazioni di servizi di test di dispositivi medici nel settore sanitario per guidare la crescita del mercato dei servizi di test di dispositivi medici nel settore sanitario
Personalizza questo report in base alle tue esigenze
Riceverai la personalizzazione gratuita di qualsiasi report, comprese parti di questo report, o analisi a livello nazionale, pacchetto dati Excel, oltre a usufruire di grandi offerte e sconti per start-up e università
- Scopri le principali tendenze di mercato in questo rapporto.Questo campione GRATUITO includerà analisi di dati che spaziano dalle tendenze di mercato alle stime e alle previsioni.
I test sui dispositivi medici richiedono una solida esperienza del dominio, delle legislazioni native e nazionali e informazioni sui dispositivi, sulle infrastrutture e sulla capacità di supportare i test. Il settore sanitario e dei dispositivi medici è attivo grazie allo sviluppo continuo e alle soluzioni avanzate. I miglioramenti nella tecnologia dei dispositivi medici hanno notevolmente migliorato l'efficienza dell'assistenza ai pazienti negli ultimi decenni.
Tuttavia, i produttori di vari dispositivi medici a volte affrontano sfide nel rendere i prodotti pronti per il mercato. Le normative sono occasionalmente complesse e difficili da comprendere, soprattutto quando si riferiscono ad applicazioni di dispositivi medici innovativi e nuovi.
Un richiamo è un processo di eliminazione o modifica di prodotti che non sono conformi alle leggi amministrate dalla Food and Drug Administration (FDA). Per lo più i richiami di dispositivi medici sono condotti volontariamente dall'azienda ai sensi del 21 CFR 7. I richiami di prodotti sono classificati in varie designazioni, come I, II o III dalla FDA per indicare il grado comparativo di rischio per la salute offerto dal prodotto richiamato.
Secondo la FDA nel 2018, sono stati identificati oltre 80.000 incidenti dal 2008, dovuti a lesioni da dispositivi medici. Da qualche anno, le aziende di dispositivi medici e i medici hanno osservato che gli stimolatori del midollo spinale hanno aiutato i pazienti che soffrono di disturbi del dolore. Per questo motivo, è diventato uno dei prodotti in più rapida crescita nel settore dei dispositivi medici da 400 miliardi di dollari. Pertanto, l'aumento dell'incidenza del ritiro dei prodotti e la maggiore domanda di prodotti di qualità stanno aumentando la necessità di testare i dispositivi medici. Quindi, ciò aumenterà il mercato dei servizi di test dei dispositivi medici.
La tecnologia dei dispositivi medici sta migliorando la vita identificando le malattie in una fase precoce e migliorando il trattamento, la diagnosi e il monitoraggio dei pazienti. I programmi di formazione per le piccole e medie imprese (PMI) sono stati implementati in paesi come Cina, Cile, Indonesia, Messico, Malesia, Singapore, Filippine, Perù, Russia e Vietnam e altri. Nel 2018, il mercato dei dispositivi medici nel Regno Unito è stato valutato approssimativamente 10,6 miliardi di dollari. Tra questi, circa 2.500 sono piccole e medie aziende di dispositivi medici nel Regno Unito. Inoltre, un gran numero di aziende multinazionali ha stabilito le proprie sedi centrali o filiali nel paese. Inoltre, ogni anno, i trust acuti spendono in media circa 6,6 miliardi di dollari in forniture cliniche, che includono apparecchiature mediche.
Inoltre, nel 2018, l'International Trade Administration (ITA) ha menzionato che ci sono oltre 1.300 aziende di dispositivi medici in Francia, di cui un terzo dell'intera società di dispositivi medici sono aziende estere. Tuttavia, queste società di dispositivi medici straniere portano circa due terzi del business totale.
Inoltre, tra le 1.300 aziende di dispositivi medici in Francia, circa il 92% sono piccole e medie imprese (PMI), di cui l'88% produce interamente dispositivi medici. Le PMI esternalizzano i test sui dispositivi medici poiché richiedono costi elevati, tempo e manodopera qualificata.
Inoltre, a Madrid e in Catalogna si registra oltre l'80 percento delle vendite di dispositivi medici. Tra queste, il 90% del mercato dei dispositivi medici è costituito da piccole e medie imprese che generano circa il 40% dei ricavi dal fatturato totale dei dispositivi medici. Poiché queste aziende sono start-up, scelgono di esternalizzare i test sui dispositivi medici per ridurre i costi e risparmiare tempo. Pertanto, è probabile che la crescente necessità nel settore guiderà la crescita del mercato globale dei servizi di test sui dispositivi medici nei prossimi anni. Portare ai consumatori una tecnologia avanzata per i dispositivi medici è un'importante
- Questo campione GRATUITO includerà analisi di dati che spaziano dalle tendenze di mercato alle stime e alle previsioni.
progetto di rischio. Pertanto, le aziende offrono test corretti fornendo risultati accurati e affidabili per i requisiti di test dei dispositivi medici, dalle piccole imprese start-up ai grandi produttori affermati.
Molti laboratori in Nord America, Europa e Asia-Pacifico offrono competenze in materia di conformità normativa e test qualificati GMP/GLP/ISO 17025 per garantire tempi di miglioramento rapidi utilizzando il massimo livello di servizio e le tecnologie più avanzate per i requisiti di test microbiologici, chimici analitici, di biocompatibilità e di confezionamento.
In altri paesi, sono presenti vari enti normativi per regolamentare i dispositivi medici. I dispositivi medici in Spagna sono controllati e autorizzati dall'Agenzia spagnola per i medicinali e i prodotti sanitari (AEMPS). Il Food and Drugs Act (FDA) ha stabilito un quadro normativo per numerosi dispositivi medici. Il Medical Devices Bureau è un altro ente responsabile delle linee guida sui dispositivi medici che consentono la vendita e l'importazione di dispositivi medici.
Tutti i dispositivi medici sono soggetti a una serie esclusiva e sistematica di requisiti di test imposti dalla FDA, dalla China Food and Drug Administration (CFDA), dagli organismi notificati dell'UE e da altri enti normativi, che devono essere rispettati prima di essere immessi sul mercato.
In Canada, Health Canada ha implementato la segnalazione obbligatoria di incidenti con dispositivi medici da parte di importatori e produttori e incoraggia inoltre la segnalazione da parte di operatori sanitari, ospedali e consumatori/pazienti. In Messico, COFEPRIS è responsabile dell'approvazione e della registrazione del dispositivo medico. Il produttore deve soddisfare tutti i requisiti di test e conformarsi alla richiesta di approvazione COFEPRIS.
Medicines and Healthcare products Regulatory Agency (MHRA) è l'autorità selezionata che amministra la legge sui dispositivi medici nel Regno Unito. Ispeziona i prodotti dei dispositivi medici con potenziali problemi e ne garantisce la sicurezza e la qualità. In Giappone, il Ministero della Salute, del Lavoro e del Welfare (MHLW) e la Pharmaceuticals and Medical Devices Agency (PMDA) lavorano insieme per condurre test scientifici sui dispositivi medici per l'applicazione di marketing per monitorarne la sicurezza post-marketing.
Pertanto, si prevede che le normative sempre più severe per dispositivi innovativi e precisi guideranno la crescita del mercato dei servizi di collaudo dei dispositivi medici durante il periodo di previsione.
Approfondimenti basati sui servizi
In termini di servizio, i servizi di test per dispositivi medici nel mercato sanitario sono segmentati in test di biocompatibilità, test chimici, test di microbiologia e sterilità e convalida del pacchetto. Nel 2018, i test di microbiologia e sterilità hanno detenuto la quota di mercato più significativa, il 53,55% del mercato dei servizi di test per dispositivi medici, per servizio.
Approfondimenti regionali sul mercato dei servizi di test sui dispositivi medici
Le tendenze regionali e i fattori che influenzano il mercato dei servizi di test dei dispositivi medici durante il periodo di previsione sono stati ampiamente spiegati dagli analisti di Insight Partners. Questa sezione discute anche i segmenti e la geografia del mercato dei servizi di test dei dispositivi medici in Nord America, Europa, Asia Pacifico, Medio Oriente e Africa e America centrale e meridionale.
- Ottieni i dati specifici regionali per il mercato dei servizi di test dei dispositivi medici
Ambito del rapporto di mercato sui servizi di test dei dispositivi medici
| Attributo del report | Dettagli |
|---|---|
| Dimensioni del mercato nel 2018 | 5,51 miliardi di dollari USA |
| Dimensioni del mercato entro il 2027 | 14,66 miliardi di dollari USA |
| CAGR globale (2018 - 2027) | 11,7% |
| Dati storici | 2016-2017 |
| Periodo di previsione | 2019-2027 |
| Segmenti coperti | Per servizio
|
| Regioni e Paesi coperti | America del Nord
|
| Leader di mercato e profili aziendali chiave |
|
Densità degli attori del mercato dei servizi di test sui dispositivi medici: comprendere il suo impatto sulle dinamiche aziendali
Il mercato dei servizi di test per dispositivi medici sta crescendo rapidamente, spinto dalla crescente domanda degli utenti finali dovuta a fattori quali l'evoluzione delle preferenze dei consumatori, i progressi tecnologici e una maggiore consapevolezza dei benefici del prodotto. Con l'aumento della domanda, le aziende stanno ampliando le loro offerte, innovando per soddisfare le esigenze dei consumatori e capitalizzando sulle tendenze emergenti, il che alimenta ulteriormente la crescita del mercato.
La densità degli operatori di mercato si riferisce alla distribuzione di aziende o società che operano in un particolare mercato o settore. Indica quanti concorrenti (operatori di mercato) sono presenti in un dato spazio di mercato in relazione alle sue dimensioni o al valore di mercato totale.
Le principali aziende che operano nel mercato dei servizi di test sui dispositivi medici sono:
- SGS SA
- Eurofin
- Tossico
- Servizi analitici di Pace, LLC
- Gruppo Intertek plc
Disclaimer : le aziende elencate sopra non sono classificate secondo un ordine particolare.
- Ottieni una panoramica dei principali attori del mercato dei servizi di test sui dispositivi medici
Approfondimenti basati sulle fasi
In base alla fase, il mercato dei servizi di test dei dispositivi medici nel settore sanitario è segmentato in preclinico e clinico. Nel 2018, il segmento preclinico deteneva una quota di mercato considerevole del 68,17% del mercato dei servizi di test dei dispositivi medici, per fase.
Gli operatori del mercato sanitario che operano nel settore dei servizi di collaudo dei dispositivi medici stanno adottando strategie di lancio ed espansione dei prodotti per soddisfare le mutevoli esigenze dei clienti in tutto il mondo, il che consente loro anche di mantenere il proprio marchio a livello globale.
Servizi di test sui dispositivi medici nel mercato sanitario – per servizio
- Test di biocompatibilità
- Prova di chimica
- Microbiologia e test di sterilità
- Validazione del pacchetto
Servizi di test sui dispositivi medici nel mercato sanitario – per fase
- Preclinico
- Clinico
Servizi di test sui dispositivi medici nel mercato sanitario – per area geografica
America del Nord
- NOI
- Canada
- Messico
Europa
- Francia
- Germania
- Italia
- Regno Unito
- Spagna
- Resto d'Europa
Asia Pacifico (APAC)
- Cina
- India
- Corea del Sud
- Giappone
- Australia
- Resto dell'APAC
Medio Oriente e Africa (MEA)
- Sudafrica
- Arabia Saudita
- Emirati Arabi Uniti
- Resto del MEA
America del Sud e America Centrale (SCAM)
- Brasile
- Argentina
- Resto della TRUFFA
Profili aziendali
- SGS SA
- Eurofin
- Tossico
- Servizi analitici di Pace, LLC
- Gruppo Intertek plc
- ASSOCIAZIONE SCIENTIFICA DEL NORD AMERICA INC.
- Fiume Carlo
- AppTec di WuXi
- Tecnologia dei materiali degli elementi
- TÜV SÜD AG
- Analisi storica (2 anni), anno base, previsione (7 anni) con CAGR
- Analisi PEST e SWOT
- Valore/volume delle dimensioni del mercato - Globale, regionale, nazionale
- Industria e panorama competitivo
- Set di dati Excel

Report Coverage
Revenue forecast, Company Analysis, Industry landscape, Growth factors, and Trends
Segment Covered
This text is related
to segments covered.

Regional Scope
North America, Europe, Asia Pacific, Middle East & Africa, South & Central America
Country Scope
This text is related
to country scope.
Trends and growth analysis reports related to Life Sciences : READ MORE..
The List of Companies
- SGS SA
- Eurofins
- Toxikon
- Pace Analytical Services, LLC
- Intertek Group plc
- NORTH AMERICAN SCIENCE ASSOCIATES INC.
- Charles River
- WuXi AppTec
- Element Materials Technology
- TÜV SÜD AG
The Insight Partners performs research in 4 major stages: Data Collection & Secondary Research, Primary Research, Data Analysis and Data Triangulation & Final Review.
- Data Collection and Secondary Research:
As a market research and consulting firm operating from a decade, we have published and advised several client across the globe. First step for any study will start with an assessment of currently available data and insights from existing reports. Further, historical and current market information is collected from Investor Presentations, Annual Reports, SEC Filings, etc., and other information related to company’s performance and market positioning are gathered from Paid Databases (Factiva, Hoovers, and Reuters) and various other publications available in public domain.
Several associations trade associates, technical forums, institutes, societies and organization are accessed to gain technical as well as market related insights through their publications such as research papers, blogs and press releases related to the studies are referred to get cues about the market. Further, white papers, journals, magazines, and other news articles published in last 3 years are scrutinized and analyzed to understand the current market trends.
- Primary Research:
The primarily interview analysis comprise of data obtained from industry participants interview and answers to survey questions gathered by in-house primary team.
For primary research, interviews are conducted with industry experts/CEOs/Marketing Managers/VPs/Subject Matter Experts from both demand and supply side to get a 360-degree view of the market. The primary team conducts several interviews based on the complexity of the markets to understand the various market trends and dynamics which makes research more credible and precise.
A typical research interview fulfils the following functions:
- Provides first-hand information on the market size, market trends, growth trends, competitive landscape, and outlook
- Validates and strengthens in-house secondary research findings
- Develops the analysis team’s expertise and market understanding
Primary research involves email interactions and telephone interviews for each market, category, segment, and sub-segment across geographies. The participants who typically take part in such a process include, but are not limited to:
- Industry participants: VPs, business development managers, market intelligence managers and national sales managers
- Outside experts: Valuation experts, research analysts and key opinion leaders specializing in the electronics and semiconductor industry.
Below is the breakup of our primary respondents by company, designation, and region:
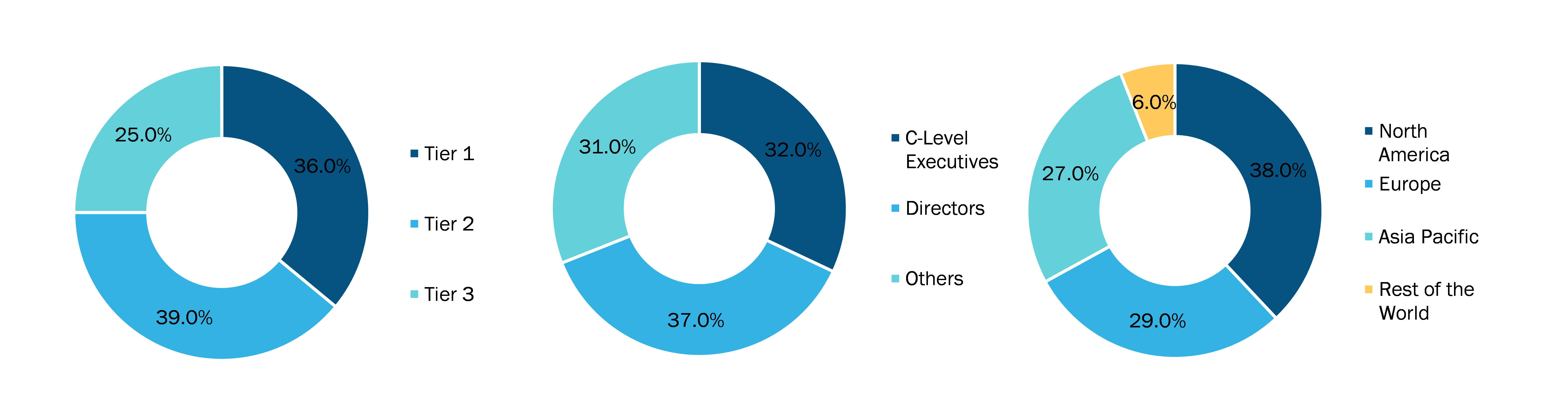
Once we receive the confirmation from primary research sources or primary respondents, we finalize the base year market estimation and forecast the data as per the macroeconomic and microeconomic factors assessed during data collection.
- Data Analysis:
Once data is validated through both secondary as well as primary respondents, we finalize the market estimations by hypothesis formulation and factor analysis at regional and country level.
- Macro-Economic Factor Analysis:
We analyse macroeconomic indicators such the gross domestic product (GDP), increase in the demand for goods and services across industries, technological advancement, regional economic growth, governmental policies, the influence of COVID-19, PEST analysis, and other aspects. This analysis aids in setting benchmarks for various nations/regions and approximating market splits. Additionally, the general trend of the aforementioned components aid in determining the market's development possibilities.
- Country Level Data:
Various factors that are especially aligned to the country are taken into account to determine the market size for a certain area and country, including the presence of vendors, such as headquarters and offices, the country's GDP, demand patterns, and industry growth. To comprehend the market dynamics for the nation, a number of growth variables, inhibitors, application areas, and current market trends are researched. The aforementioned elements aid in determining the country's overall market's growth potential.
- Company Profile:
The “Table of Contents” is formulated by listing and analyzing more than 25 - 30 companies operating in the market ecosystem across geographies. However, we profile only 10 companies as a standard practice in our syndicate reports. These 10 companies comprise leading, emerging, and regional players. Nonetheless, our analysis is not restricted to the 10 listed companies, we also analyze other companies present in the market to develop a holistic view and understand the prevailing trends. The “Company Profiles” section in the report covers key facts, business description, products & services, financial information, SWOT analysis, and key developments. The financial information presented is extracted from the annual reports and official documents of the publicly listed companies. Upon collecting the information for the sections of respective companies, we verify them via various primary sources and then compile the data in respective company profiles. The company level information helps us in deriving the base number as well as in forecasting the market size.
- Developing Base Number:
Aggregation of sales statistics (2020-2022) and macro-economic factor, and other secondary and primary research insights are utilized to arrive at base number and related market shares for 2022. The data gaps are identified in this step and relevant market data is analyzed, collected from paid primary interviews or databases. On finalizing the base year market size, forecasts are developed on the basis of macro-economic, industry and market growth factors and company level analysis.
- Data Triangulation and Final Review:
The market findings and base year market size calculations are validated from supply as well as demand side. Demand side validations are based on macro-economic factor analysis and benchmarks for respective regions and countries. In case of supply side validations, revenues of major companies are estimated (in case not available) based on industry benchmark, approximate number of employees, product portfolio, and primary interviews revenues are gathered. Further revenue from target product/service segment is assessed to avoid overshooting of market statistics. In case of heavy deviations between supply and demand side values, all thes steps are repeated to achieve synchronization.
We follow an iterative model, wherein we share our research findings with Subject Matter Experts (SME’s) and Key Opinion Leaders (KOLs) until consensus view of the market is not formulated – this model negates any drastic deviation in the opinions of experts. Only validated and universally acceptable research findings are quoted in our reports.
We have important check points that we use to validate our research findings – which we call – data triangulation, where we validate the information, we generate from secondary sources with primary interviews and then we re-validate with our internal data bases and Subject matter experts. This comprehensive model enables us to deliver high quality, reliable data in shortest possible time.

 Ottieni un campione gratuito per questo repot
Ottieni un campione gratuito per questo repot