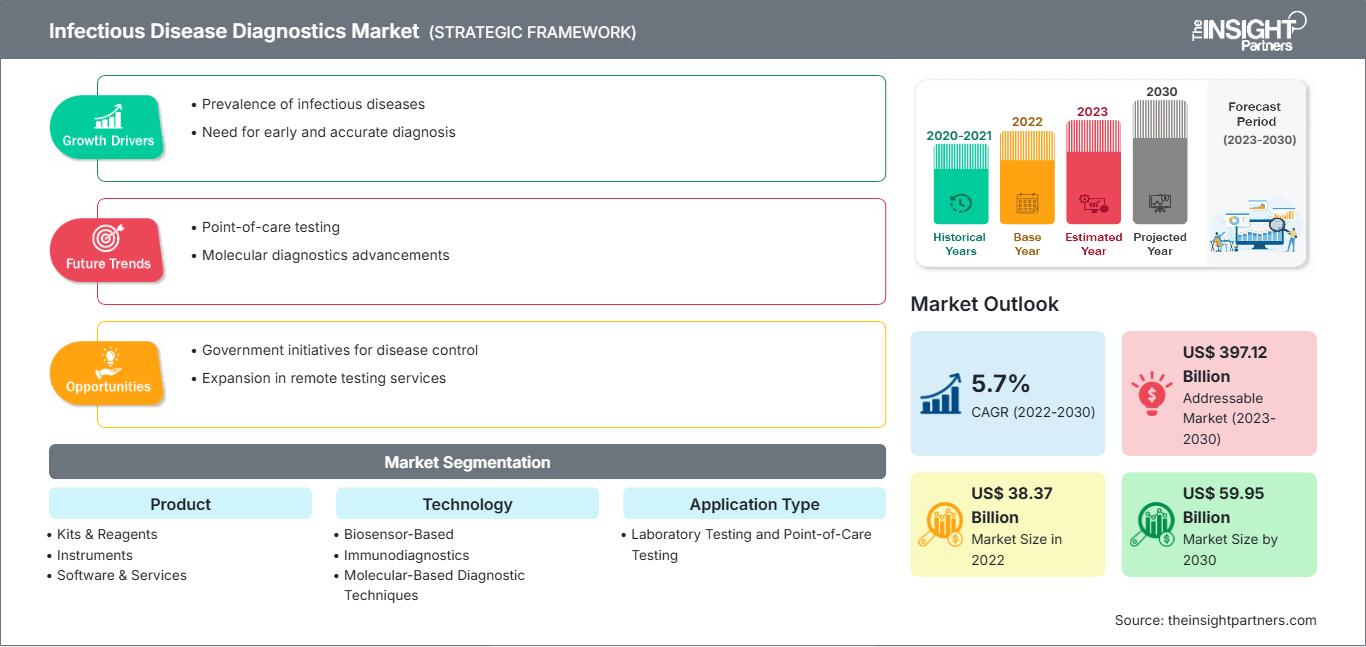
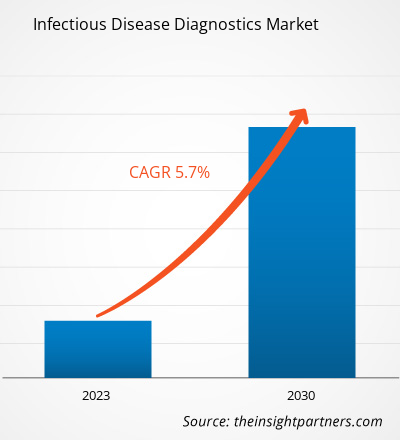
[연구 보고서] 감염병 진단 시장은 2022년 383억 6,638만 달러에서 2030년 599억 5,422만 달러로 성장할 것으로 예상되며, 2022년부터 2030년까지 연평균 성장률 5.7%를 기록할 것으로 예상됩니다.
시장 분석 및 분석가 의견:
감염병 진단 시장 규모는 감염병 발생 증가와 기술적으로 진보된 제품 개발로 인한 제품 출시 및 승인 증가로 확대되고 있습니다. 2022년 5월, BD는 완전 자동화된 고처리량 감염병 분자 진단 플랫폼인 BD COR MX 장비를 미국에서 출시했습니다. 이 장비는 샘플 처리부터 진단 검사 결과 도출까지, 대규모 고처리량 실험실의 전체 분자 검사 워크플로우를 자동화하고 통합합니다. BD COR 시스템은 검체 분류 작업을 없애 검사실 기술자가 검체와 최소한의 상호작용만 하도록 지원하여 다른 중요한 검사 과정에 시간을 할애할 수 있도록 합니다. 감염성 질환 사례 증가와 검사실 역량 및 분자 검사 시약 부족에 대응하여 일부 진단 검사 제조업체는 검사실 외부에서 검사를 용이하게 하는 빠르고 사용하기 쉬운 장치를 제공합니다.
성장 동력 및 과제:
수의학적 감염성 질환은 가축, 동물, 그리고 야생 동물의 건강에 부정적인 영향을 미칩니다. 집약적인 축산으로 인해 매년 실내에서 사육되는 수십억 마리의 동물(종종 건강이 좋지 않은)의 유전적, 물리적 근접성으로 인해 질병 유행이 발생하고 확산될 수 있는 환경이 조성되어 있습니다. 더욱이, 축산업은 농경지 이용 확대로 인한 삼림 벌채로 인해 야생 동물 감염 확산에 기여합니다.
신종 감염성 동물 질병을 조기에 진단할 수 있는 진단 기술은 이러한 질병 발생으로 인한 경제적 손실을 줄이는 데 필수적입니다. 중합효소 연쇄 반응(PCR)은 동물 병원균 검출을 위해 전 세계적으로 가장 널리 사용되는 분자 검사법입니다. 이러한 유형의 진단법은 사용이 간편하고 비용 효율적이며, 민감하고 특이적이며, 대량 검출이 가능합니다.
요구 사항에 맞게 이 보고서를 사용자 정의하십시오.
이 보고서의 일부, 국가 수준 분석, Excel 데이터 팩을 포함하여 모든 보고서에 대한 사용자 정의를 무료로 받을 수 있을 뿐만 아니라 스타트업 및 대학을 위한 훌륭한 제안 및 할인을 이용할 수 있습니다
감염병 진단 시장: 전략적 통찰력
-
이 보고서의 주요 주요 시장 동향을 확인하세요.이 무료 샘플에는 시장 동향부터 추정 및 예측에 이르기까지 데이터 분석이 포함됩니다.
기존 바이러스 검사법은 매우 신뢰할 수 있지만, 시간이 많이 소요되고 노동 집약적인 절차입니다. 측면 유동 분석법(lateral flow assay)과 효소면역흡착법(enzyme-linked immunosorbent assay)을 사용하면 신속한 검출이 가능합니다. 멀티플렉스 비드 면역(multiplex bead immuno) 또는 루미넥스(Luminex) 분석법은 형광 비드 기반의 고처리량 정량 기술로, 단일 반응에서 여러 감염성 질환에 특이적인 여러 항체를 동시에 검출하는 데 사용되며, 기존 ELISA보다 빠르고 경제적이며 정확한 결과를 제공합니다. 또한, 표면 플라스몬 공명(SPR) 기반 단백질 칩은 감염의 혈청 진단이나 항체 적정에 있어 빠르고 유용한 도구로 여겨집니다. 재조합 항체는 rDNA 기술을 사용하여 이종 시스템에서 생산될 수 있으며, 진단 검사 개발에 사용될 수 있습니다.
현장 진단(POCD)은 현장에서 질병 상태를 감지할 수 있는 간단하고 빠르며 휴대가 간편한 진단 장치입니다. 최근 몇 년 동안 실시간 PCR(qPCR)은 POCD 플랫폼으로 전환되었습니다. 이러한 완전 자동화 플랫폼은 핵산 추출, 열 사이클링, 현장 결과 보고 기능을 결합합니다. 예를 들어, Enigma Diagnostics의 MiniLab은 10~35kg의 분자 진단 플랫폼으로, 현장 운반이 가능하며 연구 목적으로 아프리카돼지열병 바이러스, 고전적 돼지열병 바이러스, 조류 인플루엔자 바이러스, 구제역 바이러스를 검증하는 데 사용됩니다. 영국 Primerdesign Ltd의 Genesig 검출 키트는 연구 목적으로 소 62종, 말 42종, 돼지 47종, 조류 60종, 개 40종, 고양이 26종의 병원균을 진단하는 동결건조 qPCR 분석 키트를 제공합니다. 마찬가지로 Boster는 최대 48개의 개별 샘플 또는 풀 샘플을 검출할 수 있는 Bosterbio qPCR 키트를 제공합니다. 유전자 발현 프로파일링, 표적 DNA 정량, 미생물 검출, 바이러스 또는 박테리아 병원체 함량 측정, 그리고 프로브 기반 qPCR의 프라이머 쌍 성능 평가에 사용됩니다. 따라서 동물의 박테리아, 바이러스, 진균 및 기생충 감염을 진단하기 위한 PCR 및 qPCR과 같은 진단 방법은 수의학 진단 분야에서 진단 기술의 발전을 촉진하고 있습니다. 대부분의 진단 검사에 대한 낮은 보험급여율은 제조업체들이 광범위한 사용을 뒷받침하기 위한 새로운 검사 개발 및 대규모 연구를 꺼리게 합니다. 또한, 새로운 검사의 비용 효율성을 뒷받침하거나 기존 검사의 효과를 입증할 만한 예상 결과가 없는 데이터가 있는 경우 보험급여율은 여전히 낮습니다. 새롭거나 값비싼 진단 검사의 보험급여에 대한 어려움과 우려는 혁신을 저해하고 진단 기술의 광범위한 보급에 심각한 어려움을 야기할 수 있습니다. 미국에서는 제3자 지불자의 보장, 지급 결정을 위한 의료 서비스 또는 질환 코드, 그리고 지급 수준 결정이 환급에 포함됩니다.
현재 절차 용어(CPT) 코드가 있는 외래 환자 검사의 경우, 메디케어 보장 자문 위원회는 충분한 근거 및 의료 혜택 결정을 포함하여 진단 검사 보장과 관련하여 메디케어 및 메디케이드 서비스 센터(CMS)를 홍보합니다. 그러나 대부분의 메디케어 보장 결정은 국가 차원이 아닌 지역 차원에서 이루어집니다. 진단 검사 보장은 지역마다 다릅니다. 또한 보장 범위 결정에 대한 기준이 부족하여 새로운 진단 제품의 개발 및 공급에 어려움을 겪을 수 있습니다.
경우에 따라 환급에 검사 비용이 포함되지 않아 검사실의 검사 제공이 제한되고 검사 가용성 및 사용이 감소합니다. 다른 경우에는 비용이 높지만 환자에게 상당한 비용을 부담시켜 의사가 정기적으로 검사를 주문하지 못하게 됩니다. 규정 준수 및 청구는 임상 검사실의 과제로 남아 있으며 검사 가용성을 제한합니다. 따라서 부적절한 보험급여 시나리오는 감염병 진단 시장의 성장을 저해합니다.
보고서 세분화 및 범위:
감염병 진단 시장은 제품별로 키트 및 시약, 장비, 소프트웨어 및 서비스로 세분화됩니다. 기술별로는 바이오센서 기반, 면역진단, 분자 기반 진단, 임상생물학 등으로 세분화됩니다. 면역진단 분야 시장은 효소면역측정법(ELISA), 웨스턴 블롯 분석, 면역형광 분석 등으로 세분화됩니다. 분자 기반 진단 기술 분야 시장은 중합효소연쇄반응(PCR), 현장교잡법(In Situ Hybridization), 등온 핵산 증폭 기술, 차세대 염기서열분석, DNA 마이크로어레이 등으로 세분화됩니다. 감염병 진단 시장은 적용 분야별로 현장진단 검사와 실험실 검사로 나뉩니다. 감염병 진단 시장은 검사 유형별로 인체 검사와 수의학적 검사로 나뉩니다. 인체 검사 부문 시장은 HIV, 간염, 원내감염(HAIs), HPV, 결핵, 인플루엔자 및 기타로 세분화됩니다. 감염병 진단 시장은 최종 사용자별로 진단 실험실, 병원 및 진료소, 연구소, 재택 치료 시설 및 기타로 세분화됩니다. 지리적 위치에 따라 감염병 진단 시장은 북미(미국, 캐나다, 멕시코), 유럽(영국, 독일, 프랑스, 이탈리아, 스페인 및 기타 유럽), 아시아 태평양(중국, 일본, 인도, 한국, 호주 및 기타 아시아 태평양), 중동 및 아프리카(UAE, 사우디아라비아, 남아프리카 및 기타 중동 및 아프리카), 남아프리카 및 기타 지역으로 세분화됩니다. 중앙아메리카(브라질, 아르헨티나 및 기타 남미 및 중앙아메리카).
세분화 분석:
감염병 진단 시장은 제품별로 키트 및 시약, 장비, 소프트웨어 및 서비스로 구분됩니다. 2022년에는 키트 및 시약 부문이 시장 점유율 1위를 차지했습니다. 그러나 소프트웨어 및 서비스 부문 시장은 2022년~2030년에 가장 빠른 속도로 성장할 것으로 예상됩니다. 키트 및 시약 부문은 Abbott, F. Hoffmann-La Roche Ltd, Bio-Rad Laboratories, Inc. 등 다수의 제조업체가 진출해 있어 성장하고 있습니다. 또한, 원내감염(HAI), 인플루엔자, HIV와 같은 감염병 사례 증가와 실험실 기반 분자 검사 역량 및 시약 부족에 대응하여 여러 진단 검사 제조업체가 실험실 외부에서 검사를 용이하게 하기 위한 빠르고 사용하기 쉬운 기기를 개발하여 판매하기 시작했습니다. 키트와 시약은 다양한 연구 과정에서 자주 사용되며, 제품 출시도 꾸준히 증가하고 있습니다. 예를 들어, 2021년 7월, 세페이드(Cepheid)는 차세대 HIV 검사 확장 검사(XC)인 Xpert HIV-1 Viral Load XC와 Xpert HIV-1 Qual XC에 대한 CE-IVD 승인을 받았다고 발표했습니다. Xpert HIV-1 Viral Load XC는 HIV-1 검출을 위한 두 번째 타겟을 제공하며, 확장된 변종 검출 범위를 제공하여 성능을 향상시키고 유전자 돌연변이 또는 결손으로 인한 위음성 결과 위험을 줄입니다. 따라서 다양한 시약 및 키트를 제공하는 다양한 시장 참여 업체의 존재와 기술 발전의 증가로 인해 이 부문은 예측 기간 동안 성장할 것으로 예상됩니다. 소프트웨어 및 서비스 부문은 기술 발전의 증가와 감염성 질환 부담을 줄이기 위한 새로운 소프트웨어 도입 등의 요인으로 인해 향후 몇 년 동안 성장할 것으로 예상됩니다. 많은 기업들이 감염병 발생률 증가를 분석하고, 시간 경과에 따른 추세와 발병 상황을 예측하며, 봉쇄 조치의 효과를 평가하는 소프트웨어를 출시하고 있습니다. 그 결과, 주로 감염자-노출자-감염자-회복자 또는 제거자(SEIR) 모델을 기반으로 하는 여러 통계 모델이 확립되었습니다. 또한, 과학계의 다학제적 협력 노력에 영감을 받아 질병 모델링 연구소(Institute for Disease Modeling)는 연구팀과 소프트웨어 팀 간의 광범위한 협업을 통해 모델링 도구를 개발해 왔습니다. 이러한 도구는 모델을 통해 감염병의 전파를 정량적이고 분석적으로 표현할 수 있는 수단을 제공합니다. IDM 소프트웨어 도구는 과학계와 자유롭게 공유되어 전산 모델링을 통해 질병 퇴치 노력을 가속화합니다. 따라서 주요 기업들의 이러한 노력은 향후 몇 년 동안 해당 부문의 성장을 촉진할 것으로 예상됩니다.
지역 분석:
감염병 진단 시장은 지리적 분포를 기준으로 북미, 유럽, 아시아 태평양, 중동 및 아프리카, 중남미로 구분됩니다. 북미는 글로벌 감염병 진단 시장 성장에 가장 큰 기여를 하고 있습니다. 아시아 태평양 지역은 2022년부터 2030년까지 감염병 진단 시장에서 가장 높은 연평균 성장률(CAGR)을 기록할 것으로 예상됩니다. 미국의 감염병 진단 시장 성장은 주로 감염병 유병률 증가, 고령 인구 증가, 그리고 주요 업체들의 제품 출시 증가에 의해 주도되고 있습니다. 60세 이상 인구는 일반적으로 면역력이 저하되어 있기 때문에 고령화는 감염병의 주요 위험 요인입니다. 2020년 인구조사국(Population Reference Bureau)에서 발표한 연구에 따르면, 2020년 미국의 65세 이상 인구는 5,500만 명이었고, 2060년까지 9,500만 명에 이를 것으로 예상됩니다. 미국의 규제 기관들은 다양한 적응증의 진단 및 치료를 위한 현장진단(POC) 제품 개발에 우호적인 정책을 시행하고 있습니다. 2021년 3월, 미국 식품의약국(FDA)은 Binx Health IO CT/NG Assay를 지역사회 기반 진료소, 응급 진료 시설 및 외래 의료 시설에 사용하도록 승인했습니다. 이 제품은 클라미디아 및 임질 감염 진단을 위한 최초의 현장진단(POC) 검사 제품입니다. 2022년 5월, 세계적인 의료 기술 기업 중 하나인 Becton Dickinson and Company(BD)는 미국 시장에 새로운 완전 자동화 고처리량 분자 진단 플랫폼을 출시한다고 발표했습니다. 새로운 BD COR MX 장비는 FDA의 510(k) 승인을 받아 BD COR 플랫폼의 분석 장비 옵션으로 출시되었습니다. 새로운 시스템에서 사용 가능한 최초의 검사인 BD CTGCTV2 분자 검사는 가장 흔한 세 가지 비바이러스성 성병(STI)인 임균(GC), 클라미디아 트라코마티스(CT), 트리코모나스 바기날리스(TV)를 단일 검사로 검출합니다.
감염성 질환 진단 시장 지역별 통찰력
The Insight Partners의 분석가들은 예측 기간 동안 감염성 질환 진단 시장에 영향을 미치는 지역별 동향과 요인을 면밀히 분석했습니다. 이 섹션에서는 북미, 유럽, 아시아 태평양, 중동 및 아프리카, 그리고 중남미 지역의 감염성 질환 진단 시장 부문 및 지역별 현황도 살펴봅니다.
감염성 질환 진단 시장 보고서 범위
| 보고서 속성 | 세부 |
|---|---|
| 시장 규모 2022 | US$ 38.37 Billion |
| 시장규모별 2030 | US$ 59.95 Billion |
| 글로벌 CAGR (2022 - 2030) | 5.7% |
| 이전 데이터 | 2020-2021 |
| 예측 기간 | 2023-2030 |
| 다루는 세그먼트 |
By 제품
|
| 포함된 지역 및 국가 |
북미
|
| 시장 선도 기업 및 주요 회사 프로필 |
|
감염병 진단 시장 참여자 밀도: 비즈니스 역학에 미치는 영향 이해
감염성 질환 진단 시장은 소비자 선호도 변화, 기술 발전, 그리고 제품 효능에 대한 인식 제고 등의 요인으로 인한 최종 사용자 수요 증가에 힘입어 빠르게 성장하고 있습니다. 수요가 증가함에 따라 기업들은 제품 및 서비스 확장, 소비자 니즈 충족을 위한 혁신, 그리고 새로운 트렌드를 적극 활용하고 있으며, 이는 시장 성장을 더욱 가속화하고 있습니다.
- 을 얻으세요 감염병 진단 시장 주요 주요 플레이어 개요
산업 개발 및 미래 기회:
감염성 질환 진단 시장에서 활동하는 주요 업체의 다양한 이니셔티브는 다음과 같습니다.
- 2023년 1월, Trinity Biotech는 imaware Inc와의 전략적 파트너십을 발표했습니다. 이 파트너십을 통해 Trinity Biotech의 고급 참조 실험실 시설과 자사의 파트너 기반 디지털 건강 플랫폼을 결합하여 재택 및 원격 테스트 프로그램으로 디지털 건강 산업을 강화했습니다.
- 2022년 11월, Bio-Rad Laboratories Inc는 InteliQ 및 Liquichek 컴팩트 바이알을 포함한 독립적인 품질 관리 제품 포트폴리오를 확장했습니다. 이 제품은 임상 화학 및 면역 분석 검사 장비와 통합된 Abbott의 Alinity CI-Series에 사용될 예정입니다.
- 2021년 12월, F. Hoffmann-La Roche Ltd는 CE 마크를 인정하는 국가에서 새로운 분자 검사 장비인 cobas 5800 시스템을 이용한 최초의 감염성 질환 검사를 출시했습니다. 여기에는 cobas HIV-1, cobas HBV, cobas HCV, cobas HIV-1/HIV-2 Qualitative, 그리고 cobas omni Utility Channel 키트가 포함됩니다. 이러한 출시는 저용량, 중용량, 대용량 분자 검사 요구 사항에 걸쳐 표준화된 성능과 효율성을 제공함으로써 Roche Molecular 포트폴리오를 확장합니다.
경쟁 환경 및 주요 기업:
Abbott Laboratories, Bruker Corp, Cardinal Health, F. Hoffmann-La Roche Ltd, Trinity Biotech Plc, Danaher Corp, Bio-Rad Laboratories Inc, AccuBioTech Co Ltd, ACON Laboratories, DiaSorin SpA는 감염성 질환 진단 시장의 주요 기업입니다. 이 기업들은 전 세계적으로 증가하는 소비자 수요를 충족하고 특수 포트폴리오의 제품 범위를 확대하기 위해 신제품 출시 및 지역 확장에 집중합니다. 글로벌 네트워크를 통해 광범위한 고객 기반을 확보하고 시장 확장을 촉진합니다.
- 과거 분석(2년), 기준 연도, CAGR을 포함한 예측(7년)
- PEST 및 SWOT 분석
- 시장 규모 가치/거래량 - 글로벌, 지역, 국가
- 산업 및 경쟁 환경
- Excel 데이터세트
최근 보고서
사용 후기
구매 이유
- 정보에 기반한 의사 결정
- 시장 역학 이해
- 경쟁 분석
- 고객 인사이트
- 시장 예측
- 위험 완화
- 전략 기획
- 투자 타당성 분석
- 신흥 시장 파악
- 마케팅 전략 강화
- 운영 효율성 향상
- 규제 동향에 발맞춰 대응





















 무료 샘플 받기 - 감염병 진단 시장
무료 샘플 받기 - 감염병 진단 시장